Er alkalimetal- og alkaliske øremetaller lignende?
Ligheder:
* placering på den periodiske tabel: Begge grupper er placeret i S-blokken i den periodiske tabel, hvilket betyder, at deres yderste elektron er i en S-orbital.
* Metallisk karakter: De er alle skinnende, sølvfarvede metaller.
* reaktivitet: De er meget reaktive elementer og mister let elektroner for at danne kationer.
* Elektropositiv: De har lave elektronegativitetsværdier, hvilket betyder, at de har en tendens til at miste elektroner og danne positive ioner.
Forskelle:
* Antal valenselektroner: Alkalimetaller har en valenselektron, mens alkaliske jordmetaller har to.
* reaktivitet: Alkalimetaller er generelt mere reaktive end alkaliske jordmetaller. Dette skyldes, at de har et svagere greb på deres enkelt valenselektron, hvilket gør det lettere at tabe.
* ioniseringsenergi: Alkalimetaller har lavere ioniseringsenergier end alkaliske jordmetaller, hvilket gør dem lettere at ionisere.
* smelte- og kogepunkter: Alkalimetaller har generelt lavere smelte- og kogepunkter end alkaliske jordmetaller. Dette skyldes den svagere metalliske binding i alkalimetaller.
* Oxidation siger: Alkalimetaller danner typisk ioner med en +1 ladning, mens alkaliske jordmetaller danner ioner med en +2 ladning.
Kortfattet:
Mens begge grupper er meget reaktive metaller, adskiller deres reaktivitet og andre egenskaber sig på grund af antallet af valenselektroner, de besidder.
 Varme artikler
Varme artikler
-
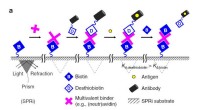 Bare at klikke et molekyle til et biomolekyle for en anden funktionEt desthiobiotin molekyle, inklusive antistof og et antigen, gør plads til biotin. Kredit:University of Twente Forskere har rapporteret et materiale, der styrer cellers adfærd på en dynamisk måde,
Bare at klikke et molekyle til et biomolekyle for en anden funktionEt desthiobiotin molekyle, inklusive antistof og et antigen, gør plads til biotin. Kredit:University of Twente Forskere har rapporteret et materiale, der styrer cellers adfærd på en dynamisk måde, -
 Pigmenter i oliemalerier forbundet med nedbrydning af kunstværkerForskere fra Brookhaven Lab og The Met er vist på beamline 5-ID på NSLS-II, hvor de analyserede en mikroskopisk prøve fra dette oliemaleri fra det 15. århundrede. Kredit:Brookhaven National Laboratory
Pigmenter i oliemalerier forbundet med nedbrydning af kunstværkerForskere fra Brookhaven Lab og The Met er vist på beamline 5-ID på NSLS-II, hvor de analyserede en mikroskopisk prøve fra dette oliemaleri fra det 15. århundrede. Kredit:Brookhaven National Laboratory -
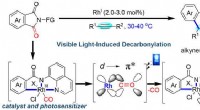 Synligt lys-induceret bifunktionel rhodiumkatalyse udviklet til decarbonylativ kobling af imider med…Lysinduceret bifunktionel rhodiumkatalyse til decarbonylering. Kredit:MIN Xiangting Carbonylgrupper er allestedsnærværende i lægemidler, naturlige produkter, og landbrugskemikalier, især amider. O
Synligt lys-induceret bifunktionel rhodiumkatalyse udviklet til decarbonylativ kobling af imider med…Lysinduceret bifunktionel rhodiumkatalyse til decarbonylering. Kredit:MIN Xiangting Carbonylgrupper er allestedsnærværende i lægemidler, naturlige produkter, og landbrugskemikalier, især amider. O -
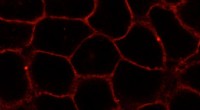 Hvordan forskere analyserer cellemembranerEn ny forbindelse, der efterligner naturligt kolesterol i membraner af levende celler (her:HeLa-celler). Stoffet er mærket med et fluorescerende farvestof (rødt). Kredit:L. Rakers et al./ Cell Chem B
Hvordan forskere analyserer cellemembranerEn ny forbindelse, der efterligner naturligt kolesterol i membraner af levende celler (her:HeLa-celler). Stoffet er mærket med et fluorescerende farvestof (rødt). Kredit:L. Rakers et al./ Cell Chem B
- Stigende globale temperaturer peger på fremtidige udbredte tørker
- Udfordringerne og potentielle fordele ved at gå over til koncentreret solenergi for at afsalte havv…
- Forskere afslører multi-skala karakteristika for helicitet i vægafgrænsede turbulente strømme
- Tung brug af tv og computer påvirker børns akademiske resultater
- Hvor 'klæbrig' er tæt nukleart stof?
- Hvad er en Bump Fire Stock?


