Hvilke ligheder findes blandt skaldiagrammerne for alkalimetaller?
1. Valence Electron: Alle alkalimetaller har en valenselektron i deres yderste skal. Det er det, der definerer dem som alkalimetaller og giver dem deres karakteristiske reaktivitet.
2. Antal elektronskaller: Antallet af elektronskaller øges, når du bevæger dig ned ad gruppen. Dette betyder, at Lithium (Li) har 2 skaller, natrium (NA) har 3, kalium (K) har 4, og så videre.
3. Fyldte indre skaller: De indre elektronskaller af alkalimetaller er fuldstændigt fyldt med elektroner bortset fra den yderste skal. Dette giver atomets stabilitet.
4. Lignende reaktivitet: Den enkelte valenselektron holdes løst og deltager let i kemiske reaktioner, hvilket gør alle alkalimetaller meget reaktive.
5. Lignende kemiske egenskaber: På grund af deres lignende elektroniske konfigurationer udviser alkalimetaller lignende kemiske egenskaber. De mister let deres enkelt valenselektron til dannelse af +1 kationer. De reagerer kraftigt med vand, producerer brintgas og et metalhydroxid.
Eksempel:
* lithium (Li): 2 elektroner i den første skal, 1 elektron i den anden skal.
* natrium (NA): 2 elektroner i den første skal, 8 elektroner i den anden skal, 1 elektron i den tredje skal.
* kalium (k): 2 elektroner i den første skal, 8 elektroner i den anden skal, 8 elektroner i den tredje skal, 1 elektron i den fjerde skal.
Som du kan se, har hvert element et andet antal skaller, men mønsteret af fyldte indre skaller og en enkelt valenselektron forbliver konsistent, hvilket forklarer deres lignende kemiske opførsel.
Sidste artikelHvad sker der, når du blander ammoniak og bagepulver?
Næste artikelHvad er forholdet mellem atom og element?
 Varme artikler
Varme artikler
-
 Forskere udvikler en innovativ metode til udfyldning og forsegling af pleurahulerAlfonso de Lucas Freile og José Miguel Martín Martínez. Kredit:Asociación RUVID Forskere fra University of Alicante Adhesion and Adhesive Lab og Thorax Surgery Service fra Albacete University Hosp
Forskere udvikler en innovativ metode til udfyldning og forsegling af pleurahulerAlfonso de Lucas Freile og José Miguel Martín Martínez. Kredit:Asociación RUVID Forskere fra University of Alicante Adhesion and Adhesive Lab og Thorax Surgery Service fra Albacete University Hosp -
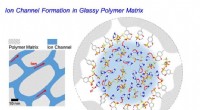 Vil stærk og hurtigt skiftende kunstig muskel være mulig?Skematisk diagram af ionkanaldannelse inde i polymerelektrolytten. Kredit:POSTECH I den amerikanske actionfilm Pacific Rim kæmper gigantiske robotter kaldet Jaegers mod ukendte monstre for at redde
Vil stærk og hurtigt skiftende kunstig muskel være mulig?Skematisk diagram af ionkanaldannelse inde i polymerelektrolytten. Kredit:POSTECH I den amerikanske actionfilm Pacific Rim kæmper gigantiske robotter kaldet Jaegers mod ukendte monstre for at redde -
 Ny indsigt i træning af højreaktive kemiske forbindelserDr. Jonas Warneke forklarer kemien bag meget reaktive molekyler, som forskes på Wilhelm Ostwald Instituttet. Kredit:Universität Leipzig Meget reaktive molekyler kan ikke overleve længe i naturen.
Ny indsigt i træning af højreaktive kemiske forbindelserDr. Jonas Warneke forklarer kemien bag meget reaktive molekyler, som forskes på Wilhelm Ostwald Instituttet. Kredit:Universität Leipzig Meget reaktive molekyler kan ikke overleve længe i naturen. -
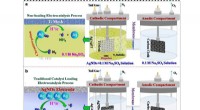 Nyt elektrokatalysesystem realiserer omgivende ammoniakelektrosynteseSkematisk illustration af en. den ikke-belastende NRR-elektrokatalyseproces og b. den traditionelle elektrokatalyseproces, der belaster katalysatoren. Kredit:LI Wenyi Det er almindeligt kendt, at
Nyt elektrokatalysesystem realiserer omgivende ammoniakelektrosynteseSkematisk illustration af en. den ikke-belastende NRR-elektrokatalyseproces og b. den traditionelle elektrokatalyseproces, der belaster katalysatoren. Kredit:LI Wenyi Det er almindeligt kendt, at
- Hvordan verdens mest præcise ur kunne transformere fundamental fysik
- Sådan designer du byer, hvor både mennesker og natur kan blomstre
- Hvordan svingende iltniveauer kan have accelereret dyrenes udvikling
- Undersøgelse om mangfoldighed og inklusion:Hvad fagfolk forventer af fremtidige arbejdsgivere
- Forskere lærer, hvorfor vandpattedyr skal være store, men ikke for store
- Neuralt netværk trænet til at vurdere brandeffekter


