Hvad er anoden af galvanisk celle fremstillet med zink og alumminum?
Forståelse af galvaniske celler
* galvaniske celler: Dette er elektrokemiske celler, der genererer elektricitet gennem spontane redoxreaktioner.
* anode: Elektroden, hvor oxidation forekommer (tab af elektroner).
* katode: Elektroden, hvor reduktion forekommer (forstærkning af elektroner).
Bestemmelse af anoden
1. Identificer det mere reaktive metal: Zink er mere reaktiv end aluminium. Dette betyder, at zink har en større tendens til at miste elektroner og oxideres.
2. Anvend reaktivitetsserien: Reaktivitetsserien af metaller hjælper med at forudsige, hvilket metal der oxideres (fungerer som anoden). Metaller, der er højere i serien, er mere reaktive.
3. Konklusion: Da zink er mere reaktiv end aluminium, vil det være anoden i den galvaniske celle.
Reaktionsoversigt
I denne galvaniske celle:
* anode (zink): Zn (S) → Zn²⁺ (aq) + 2e⁻ (oxidation)
* katode (aluminium): Al³⁺ (aq) + 3e⁻ → Al (s) (reduktion)
Nøglepunkt: Den samlede reaktion i cellen er kombinationen af disse to halvreaktioner med elektroner, der flyder fra zinkanoden til aluminiumkatoden gennem et eksternt kredsløb.
 Varme artikler
Varme artikler
-
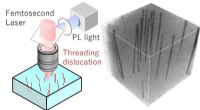 Ikke -destruktiv karakteriseringsteknik hjælper udviklingen af galliumnitridkrystalFig. 1. Målesystem og observationsbillede af TDer i GaN -halvleder ved fotoluminescensmetode med multiphoton -excitation. TDer observeres som mørke linjer. Kredit:Osaka University Fig. 1. Målesystem o
Ikke -destruktiv karakteriseringsteknik hjælper udviklingen af galliumnitridkrystalFig. 1. Målesystem og observationsbillede af TDer i GaN -halvleder ved fotoluminescensmetode med multiphoton -excitation. TDer observeres som mørke linjer. Kredit:Osaka University Fig. 1. Målesystem o -
 Kulmonoxid bliver til stor defektfri grafenkrystal under omgivende trykSnefnug ætset i grafen hos Skoltech. De lyse områder er grafen, og de mørke er oxideret kobber. Snefnugmønsteret opstod, da det omgivende grafen blev ætset væk af kuldioxid i et af eksperimenterne, fø
Kulmonoxid bliver til stor defektfri grafenkrystal under omgivende trykSnefnug ætset i grafen hos Skoltech. De lyse områder er grafen, og de mørke er oxideret kobber. Snefnugmønsteret opstod, da det omgivende grafen blev ætset væk af kuldioxid i et af eksperimenterne, fø -
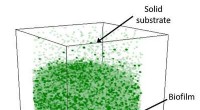 Ind i det molekylære øje:Undersøgelse af flydende prøver i realtidEt 3D-molekylær ionbillede giver forskere mulighed for at spore en PO 3 arter i en levende biofilm, der vokser under et fast substrat. Kredit:Environmental Molecular Sciences Laboratory Biofilm
Ind i det molekylære øje:Undersøgelse af flydende prøver i realtidEt 3D-molekylær ionbillede giver forskere mulighed for at spore en PO 3 arter i en levende biofilm, der vokser under et fast substrat. Kredit:Environmental Molecular Sciences Laboratory Biofilm -
 Konvertering af sollys til brændstof:Udvikling af mere effektive fotokatoderGrafisk abstrakt. Kredit:Journal of the American Chemical Society (2022). DOI:10.1021/jacs.2c04301 Fotoelektrokemiske celler er lovende værktøjer til omdannelse af sollys til brændstof, for eksempe
Konvertering af sollys til brændstof:Udvikling af mere effektive fotokatoderGrafisk abstrakt. Kredit:Journal of the American Chemical Society (2022). DOI:10.1021/jacs.2c04301 Fotoelektrokemiske celler er lovende værktøjer til omdannelse af sollys til brændstof, for eksempe
- Sådan kalibreres en Autoclave
- Cypern fremviser en gammel undersøisk havn for at tiltrække turister
- Hvad ved forsker om Carbon12 Carbon14-atomer?
- Nyt kørestolsdesign - et håndudstyr til bedre ergonomi
- Forskere høster data fra hawaiier, der buldrer Kilauea -vulkanen
- Forsker skaber optisk magnetometer prototype, der registrerer fejl i MR-scanninger


