Hvorfor kan alkalimetaller og jord danne kation?
1. Elektronkonfiguration:
* alkalimetaller (gruppe 1): Har en valenselektron (elektron i den yderste skal).
* alkaliske jordmetaller (gruppe 2): Har to valenselektroner.
2. Noble Gas Configuration:
* Atomer er mest stabile, når deres yderste skal er fuld.
* Ædle gasser (gruppe 18) har en fuld ydre skal, hvilket gør dem meget ureaktive.
3. Dannelse af kationer:
* alkalimetaller Mist let deres enkelt valenselektron for at danne en +1 -kation, opnå den stabile elektronkonfiguration af den foregående ædle gas. For eksempel mister natrium (NA) en elektron for at blive Na⁺, som har den samme elektronkonfiguration som neon (NE).
* alkaliske jordmetaller Tab deres to valenselektroner for at danne en +2 -kation, og opnå også den stabile elektronkonfiguration af den foregående ædle gas. For eksempel mister magnesium (Mg) to elektroner for at blive Mg²⁺, som har den samme elektronkonfiguration som neon (NE).
Kortfattet:
* Alkalimetaller og alkaliske jordmetaller har en stærk tendens til at miste elektroner for at opnå en stabil elektronkonfiguration.
* Dette tab af elektroner resulterer i dannelsen af positivt ladede ioner (kationer).
Eksempel:
* natrium (NA): [Ne] 3S¹ → Na⁺ + E⁻ (mister en elektron, bliver som neon)
* magnesium (mg): [Ne] 3S² → Mg²⁺ + 2e⁻ (mister to elektroner, bliver som neon)
Den lethed, hvormed alkalimetaller og alkaliske jordmetaller danner kationer, er en nøglefaktor i deres kemiske reaktivitet. De deltager let i ionisk binding og danner salte med ikke -metaller.
Sidste artikelHvorfor bruges NH3 i køleskab?
Næste artikelHvis nuklear fusion var mulig, hvor mange kWh ville det producere?
 Varme artikler
Varme artikler
-
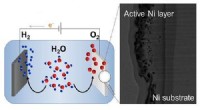 Opdeling af vand til prisen for et nikkelEt elektronmikroskopbillede af en nikkelanode (til højre), der øger ilt-udviklingsreaktionen, der er vigtig for vandspaltning (til venstre). Kredit:KAUST En teknik til at skabe et materiale til om
Opdeling af vand til prisen for et nikkelEt elektronmikroskopbillede af en nikkelanode (til højre), der øger ilt-udviklingsreaktionen, der er vigtig for vandspaltning (til venstre). Kredit:KAUST En teknik til at skabe et materiale til om -
 Tagging for metallegeringer genkender og mærker detaljerede mikroskopiske strukturerMetallurger er meget interesserede i at analysere materialemikrostrukturer, fordi de bestemmer deres egenskaber, ” siger Dmitry Bulgarevich fra Japans National Institute for Materials Science (NIMS).
Tagging for metallegeringer genkender og mærker detaljerede mikroskopiske strukturerMetallurger er meget interesserede i at analysere materialemikrostrukturer, fordi de bestemmer deres egenskaber, ” siger Dmitry Bulgarevich fra Japans National Institute for Materials Science (NIMS). -
 Computermodeller giver ny forståelse af seglcellesygdomEn ny modelleringsteknik gør det muligt for forskere at se, hvad der sker inde i røde blodlegemer, der er ramt af seglcellesygdom. Kredit:Karniadakis lab / Brown University Computermodeller udvikl
Computermodeller giver ny forståelse af seglcellesygdomEn ny modelleringsteknik gør det muligt for forskere at se, hvad der sker inde i røde blodlegemer, der er ramt af seglcellesygdom. Kredit:Karniadakis lab / Brown University Computermodeller udvikl -
 Ekstremt stærke og alligevel utrolig duktile flerkomponentlegeringer udvikletDen nye legering Al 7 Ti 7 udviser en overlegen styrke på 1,5 gigapascal og duktilitet så høj som 50 procent i spænding ved omgivelsestemperatur. Kredit:City University of Hong Kong Et forsker
Ekstremt stærke og alligevel utrolig duktile flerkomponentlegeringer udvikletDen nye legering Al 7 Ti 7 udviser en overlegen styrke på 1,5 gigapascal og duktilitet så høj som 50 procent i spænding ved omgivelsestemperatur. Kredit:City University of Hong Kong Et forsker
- Spansk sprog bliver stadig mere relevant for præsidentvalg
- Bestræbelser på at masseproducere fleksibel elektronik i nanoskala
- Almindelig rørlegering kan danne kræftfremkaldende kemikalie i drikkevand
- Hvor mange centicubes tilsættes en målecylinder med vand, hvis niveauet steg med 25 ml?
- Let indendørs regnbueeksperimenter
- Sådan beregnes friktionskraften


