Hvordan bestemmer du, hvilke et af produkterne i en nedbørreaktion er bundfald?
1. Forstå opløselighedsregler
* opløselighedsregler: Dette er retningslinjer, der fortæller dig, hvilke ioniske forbindelser der er opløselige (opløses i vand), og hvilke der er uopløselige (danner et bundfald). Du bliver nødt til at gøre dig bekendt med disse regler, som normalt leveres i din lærebog eller online ressourcer.
2. Identificer de tilstedeværende ioner
* Skriv den afbalancerede kemiske ligning for reaktionen. Dette viser dig de ioner, der er til stede før og efter reaktionen.
* Eksempel: Overvej reaktionen mellem sølvnitrat (Agno₃) og natriumchlorid (NaCl):
Agno₃ (aq) + NaCl (aq) → Agcl (s) + nano₃ (aq)
* ioner til stede: Ag⁺, no₃⁻, na⁺, cl⁻
3. Anvend opløselighedsregler
* Se efter de mulige kombinationer af ioner, der kunne danne et bundfald. I vores eksempel er de mulige kombinationer:
* Agcl
* Nano₃
* Konsulter dine opløselighedsregler for at bestemme, hvilke af disse kombinationer der er uopløseligt.
* AGCL: Sølvchlorid (AGCL) er generelt uopløseligt i henhold til opløselighedsregler.
* nano₃: Natriumnitrat (nano₃) er generelt opløselig.
4. Identificer bundfaldet
* Den uopløselige forbindelse er bundfaldet. I vores eksempel er AGCL bundfaldet, og det vil danne et solidt, der falder ud af opløsningen.
nøglepunkter at huske:
* (aq) betyder, at forbindelsen opløses i vand (vandig).
* (s) betyder, at forbindelsen er et solidt (bundfald).
* nedbørreaktioner resulterer ofte i dannelse af et fast stof, der kan observeres som et overskyet eller mælkeagtigt stof i opløsningen.
Lad mig vide, om du gerne vil øve med et specifikt eksempel!
Sidste artikelHvordan vil du vide, om et sammensat bundfald efter substitutionsreaktion?
Næste artikelKan barium kombineres med elementer?
 Varme artikler
Varme artikler
-
 Hurtigere og grønnere renseproces med kuldioxidKredit:Karlstad Universitet For at lægemidler skal være sikre, de skal være rene for forurenende stoffer. Kuldioxid kan bruges til at gøre rensningsprocessen mere miljøvenlig, hvilket kan virke pa
Hurtigere og grønnere renseproces med kuldioxidKredit:Karlstad Universitet For at lægemidler skal være sikre, de skal være rene for forurenende stoffer. Kuldioxid kan bruges til at gøre rensningsprocessen mere miljøvenlig, hvilket kan virke pa -
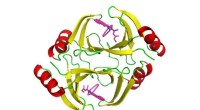 Undersøgelse giver nye spor til forbedring af kemoterapierStrukturen af proteinet kodet af tnmS3-genet. Kredit:Shen Lab/Scripps Research Omkring halvdelen af alle stoffer, lige fra morfin til penicillin, kommer fra forbindelser, der er fra - eller er
Undersøgelse giver nye spor til forbedring af kemoterapierStrukturen af proteinet kodet af tnmS3-genet. Kredit:Shen Lab/Scripps Research Omkring halvdelen af alle stoffer, lige fra morfin til penicillin, kommer fra forbindelser, der er fra - eller er -
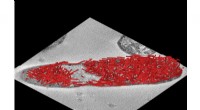
 Gennembrud inden for ligninforskning - sfæriske partikler formerer enzymeffektivitetenBiokatalysatorer (billedet i bunden af hætteglasset), understøttet af sfæriske ligninpartikler og indlejret i naturlig polymermatrix, åbne nye veje til grønne syntesereaktioner i nærvær af vand. Kre
Gennembrud inden for ligninforskning - sfæriske partikler formerer enzymeffektivitetenBiokatalysatorer (billedet i bunden af hætteglasset), understøttet af sfæriske ligninpartikler og indlejret i naturlig polymermatrix, åbne nye veje til grønne syntesereaktioner i nærvær af vand. Kre -
 Bakterieudvikling markerer en ny æra inden for cellulært designGrafisk billede af rørformede stilladser i celler. Kredit:University of Kent Forskere ved universiteterne i Kent og Bristol har bygget et miniaturestillads inde i bakterier, der kan bruges til at
Bakterieudvikling markerer en ny æra inden for cellulært designGrafisk billede af rørformede stilladser i celler. Kredit:University of Kent Forskere ved universiteterne i Kent og Bristol har bygget et miniaturestillads inde i bakterier, der kan bruges til at
- Nyt solcellemateriale kunne rense drikkevandet
- Dine politiske holdninger kan forudsige, hvordan du udtaler bestemte ord
- Hvad er den mest anvendte polymer?
- Klimaændringer og orkaner:har vi brug for en rygende pistol?
- Halvdelen af verdens strande kunne forsvinde i 2100
- NASAs Aqua Satellite sporer supertyfonen Yutus aflange øje


