Kan barium kombineres med elementer?
almindelige forbindelser:
* ilt: Barium reagerer let med ilt for at danne bariumoxid (BAO), et hvidt fast stof. Denne reaktion er så kraftig, at barium ofte opbevares under olie eller en inert atmosfære for at forhindre, at den reagerer med luft.
* halogener: Barium reagerer kraftigt med halogener (fluor, chlor, brom og jod) til dannelse af halogenider såsom bariumfluorid (BAF₂), bariumchlorid (bacl₂), bariumbromid (Babr₂) og bariumiodid (Bai₂).
* Vand: Barium reagerer voldsomt med vand for at producere bariumhydroxid (BA (OH) ₂) og brintgas.
* syrer: Barium reagerer med syrer for at danne bariumsalte og brintgas.
* svovl: Barium reagerer med svovl for at danne bariumsulfid (BAS).
* carbon: Barium kan reagere med carbon for at danne bariumcarbid (BAC₂).
mindre almindelige forbindelser:
* nitrogen: Barium kan danne nitrider som bariumnitrid (Ba₃n₂) under specifikke forhold.
* fosfor: Det kan også danne forbindelser med fosfor som bariumphosphid (Ba₃p₂).
Bemærk: Bariumforbindelser er ofte giftige, så håndtering af dem kræver forsigtighed.
Vigtige overvejelser:
* Bariumens reaktivitet gør det vanskeligt at finde det i sin rene elementære form.
* De nøjagtige betingelser (temperatur, tryk, tilstedeværelse af katalysatorer) kan påvirke, hvilke forbindelser der dannes.
I resuméet kan barium kombineres med en lang række elementer til dannelse af et væld af forbindelser, hvoraf mange er vigtige i forskellige industrielle og videnskabelige anvendelser.
 Varme artikler
Varme artikler
-
 Forskere kombinerer levende og livløse stofferOleg Bolshakov. Kredit:SUSU Moderne kosmetik og medicinske implantater indeholder mange uorganiske stoffer. Undersøgelser fra forskere fra South Ural State University har til formål at forstå, hvo
Forskere kombinerer levende og livløse stofferOleg Bolshakov. Kredit:SUSU Moderne kosmetik og medicinske implantater indeholder mange uorganiske stoffer. Undersøgelser fra forskere fra South Ural State University har til formål at forstå, hvo -
 Nyt materiale skabt til at rydde op i fossilindustrienKredit:Pixabay Forskere ved University of Sydney har skabt et nyt materiale, der har potentiale til at reducere CO 2 emissioner frigivet under raffineringsprocessen af råolie med op til 28 pro
Nyt materiale skabt til at rydde op i fossilindustrienKredit:Pixabay Forskere ved University of Sydney har skabt et nyt materiale, der har potentiale til at reducere CO 2 emissioner frigivet under raffineringsprocessen af råolie med op til 28 pro -
 Metalion-gennembrud fører til nye biomaterialerMetaller som jern og calcium spiller en afgørende rolle i den menneskelige krop, så det er ingen overraskelse, at bioingeniører gerne vil integrere dem i det bløde, strækbare materialer, der bruges ti
Metalion-gennembrud fører til nye biomaterialerMetaller som jern og calcium spiller en afgørende rolle i den menneskelige krop, så det er ingen overraskelse, at bioingeniører gerne vil integrere dem i det bløde, strækbare materialer, der bruges ti -
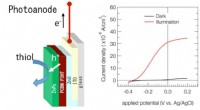 Miljøvenlige elektrokemiske katalysatorer, der bruger solceller til at høste energi fra solenStrukturen af den foreslåede enhed, viser, hvordan de genererede huller (h+) bruges til at lette thioloxidation. Den målte strøm stiger dramatisk under belysning og anvendelse af et lille potentiale
Miljøvenlige elektrokemiske katalysatorer, der bruger solceller til at høste energi fra solenStrukturen af den foreslåede enhed, viser, hvordan de genererede huller (h+) bruges til at lette thioloxidation. Den målte strøm stiger dramatisk under belysning og anvendelse af et lille potentiale
- Enkel teknik giver mulighed for nøjagtige computersimuleringer af calciumsignalering
- "Dominant Allele: What is it?", 3, [[& Hvorfor sker det? (med trækdiagram)
- Hvordan virker tørre kemiske ildslukkere?
- Forskere finder den optimale måde at betale studielån på
- NASA-eksperiment kaster lys over højt ladet månestøv
- Stimulering af differentieringen af knogleprækursorer med organisk modificeret hydroxyapatit (orm…


