Reducerer baser cncentrationen af brintioner i en opløsning?
* Brønsted-Lowry Definition: En base er et stof, der accepterer hydrogenioner (H+). Når en base føjes til en opløsning, reagerer den med H+ -ioner og fjerner dem fra opløsningen.
* ph -skala: PH -skalaen måler surhedsgraden eller grundlæggende af en opløsning. Lavere pH -værdier indikerer højere H+ -koncentration (sur), mens højere pH -værdier indikerer lavere H+ -koncentration (grundlæggende).
* hydroxidioner (OH-): Mange baser producerer hydroxidioner (OH-) i opløsning. Hydroxidioner reagerer med hydrogenioner for at danne vand (H2O), hvilket yderligere reducerer H+ -koncentrationen.
Eksempel:
Overvej tilsætning af natriumhydroxid (NaOH) til vand. NaOH er en stærk base og adskiller sig fuldstændigt i vand for at danne natriumioner (Na+) og hydroxidioner (OH-):
NaOH (aq) → Na + (aq) + OH- (aq)
Hydroxidionerne reagerer med hydrogenioner, der allerede er til stede i vandet:
H + (aq) + OH- (aq) → H2O (L)
Denne reaktion fjerner H+ -ioner fra opløsningen, øger pH og gør opløsningen mindre sur (mere grundlæggende).
Sidste artikelHvad er triiodomethanreaktionen af phenol?
Næste artikelHvad frigøres ellers, når et nukleotid er lavet?
 Varme artikler
Varme artikler
-
 Ny metode til at fremstille kompositter med formhukommelseFormhukommelsestest af hærdet harpiks og pultruderede kompositprøver:(a) Deformeret prøve af hærdet harpiks i testfiksturen efter opvarmning; (b) hærdede harpiksprøver efter formfiksering; (c) hærdede
Ny metode til at fremstille kompositter med formhukommelseFormhukommelsestest af hærdet harpiks og pultruderede kompositprøver:(a) Deformeret prøve af hærdet harpiks i testfiksturen efter opvarmning; (b) hærdede harpiksprøver efter formfiksering; (c) hærdede -
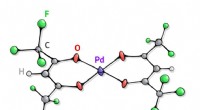 Kemikere accelererede vinylsulfider-reaktionen 10 gangeKatalysatorens opbygning. Kredit:RUDN Universitet Et team af forskere skabte og testede en mere effektiv katalysator til at opnå vinylsulfider. Disse forbindelser kan bruges til udvikling af nye m
Kemikere accelererede vinylsulfider-reaktionen 10 gangeKatalysatorens opbygning. Kredit:RUDN Universitet Et team af forskere skabte og testede en mere effektiv katalysator til at opnå vinylsulfider. Disse forbindelser kan bruges til udvikling af nye m -
 Ny sammensat katalysator holder løfte om omkostningseffektiv omdannelse af ethanol til jet-brændst…Luftfart bidrager med omkring 2,5% af de globale kuldioxidemissioner. For i høj grad at reducere sine emissioner, den amerikanske kommercielle luftfartssektor har brug for nye metoder til fremstilling
Ny sammensat katalysator holder løfte om omkostningseffektiv omdannelse af ethanol til jet-brændst…Luftfart bidrager med omkring 2,5% af de globale kuldioxidemissioner. For i høj grad at reducere sine emissioner, den amerikanske kommercielle luftfartssektor har brug for nye metoder til fremstilling -
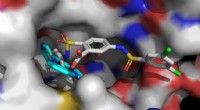 Mod udvikling af lægemidler til aldringsrelaterede sygdommeSirt6-aktivatorerne UBCS039 (cyan, foran til venstre) og MDL-801 (flerfarvet, foran til højre) er forankret i den samme bindingslomme på Sirt6. Det længere MDL-801-molekyle kontakter også tilstødende
Mod udvikling af lægemidler til aldringsrelaterede sygdommeSirt6-aktivatorerne UBCS039 (cyan, foran til venstre) og MDL-801 (flerfarvet, foran til højre) er forankret i den samme bindingslomme på Sirt6. Det længere MDL-801-molekyle kontakter også tilstødende
- Sådan fungerer jern og stål
- Vilde gener hos husdyr:Hvordan vi kan overlade vores afgrøder ved hjælp af deres fjerne slægtning…
- Gamle istidsdale giver fingerpeg om fremtidige indlandsisskift
- Omlægninger fra Rødehavet udsender CO2-emissioner svarende til 9 millioner biler
- Diamantkapsler forbedrer ydeevnen af laserfusion
- At lave Træ Rain Gutters


