Hvornår mister et atom elektroner gennem ionisk binding?
* ionisk binding: En ionisk binding dannes, når det ene atom (metallet) mister elektroner og bliver positivt ladet (kation), mens det andet atom (ikke -metalen) får disse elektroner og bliver negativt ladet (anion). De modsatte afgifter tiltrækker derefter hinanden og skaber båndet.
* ioniseringsenergi: Ioniseringsenergi er den energi, der kræves for at fjerne et elektron fra et neutralt atom i dens gasformige tilstand. Atomer med lav ioniseringsenergier er mere tilbøjelige til at miste elektroner, fordi det kræver mindre energi at gøre det.
Sådan fungerer det mere detaljeret:
1. Metaller: Metaller har typisk lave ioniseringsenergier. Dette betyder, at det er lettere at fjerne elektroner fra dem.
2. ikke -metaller: Ikke -metaller har højere ioniseringsenergier, hvilket betyder, at det kræver mere energi at fjerne elektroner.
3. Elektronoverførsel: Når et metal og en ikke -metal kommer sammen, mister metalatomet let en elektron (eller elektroner) for at blive en kation, og ikke -metalatomet får disse elektroner til at blive en anion.
4. Elektrostatisk attraktion: De modsatte ladede ioner tiltrækkes derefter af hinanden gennem elektrostatiske kræfter og danner den ioniske binding.
Eksempel:
Overvej dannelsen af natriumchlorid (NaCl):
* natrium (NA) er et metal med en lav ioniseringsenergi. Det mister let en elektron for at blive en natriumion (Na+).
* klor (Cl) er en ikke -metal med en højere ioniseringsenergi. Det får det elektron, der er tabt ved natrium, for at blive en chloridion (CL-).
* Na+ og Cl- ioner tiltrækker derefter hinanden og danner den ioniske forbindelse NaCl.
Kortfattet: Atomer med lave ioniseringsenergier er mere tilbøjelige til at miste elektroner og danne ioniske bindinger med atomer, der har en høj elektronegativitet.
Sidste artikelEr ilt produceret fra en base i vand?
Næste artikelHvorfor er den periodiske tabel relateret til medicin?
 Varme artikler
Varme artikler
-
 Nyt bioremedieringsmateriale kan rense for evigt kemikalierPFAS adsorberes i plantematerialets cellevæg. Når svampen fortærer planten, spiser den også det kemikalie, der blev adsorberet. Kredit:Susie Dai En ny bioremedieringsteknologi til oprensning af per
Nyt bioremedieringsmateriale kan rense for evigt kemikalierPFAS adsorberes i plantematerialets cellevæg. Når svampen fortærer planten, spiser den også det kemikalie, der blev adsorberet. Kredit:Susie Dai En ny bioremedieringsteknologi til oprensning af per -
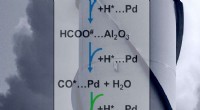 Forskere viser, hvordan man styrer katalysator, der gør en drivhusgas til et brændstof eller råst…De grønne pile viser det afgørende trin i styringen af reaktionernes slutprodukter:metan eller kulilte. Kredit:Scott Butner Hvad hvis vi kunne vende kuldioxid, CO2, til en værdifuld ressource? B
Forskere viser, hvordan man styrer katalysator, der gør en drivhusgas til et brændstof eller råst…De grønne pile viser det afgørende trin i styringen af reaktionernes slutprodukter:metan eller kulilte. Kredit:Scott Butner Hvad hvis vi kunne vende kuldioxid, CO2, til en værdifuld ressource? B -
 Resonansforbedret tunneling inducerer flour- og para-hydrogenreaktion i interstellare skyerDe høje søjler og runde kugler af mørkt støv og kold molekylær gas i stjerneskyer Kredit:T. A. Rector &B. A. Wolpa, NOAO, AURA Forskere fra Dalian Institute of Chemical Physics (DICP) fra det kine
Resonansforbedret tunneling inducerer flour- og para-hydrogenreaktion i interstellare skyerDe høje søjler og runde kugler af mørkt støv og kold molekylær gas i stjerneskyer Kredit:T. A. Rector &B. A. Wolpa, NOAO, AURA Forskere fra Dalian Institute of Chemical Physics (DICP) fra det kine -
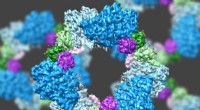 Forskere leverer højopløsnings glimt af enzymstrukturVed hjælp af en state-of-the-art type elektronmikroskopi, et MIT-ledet hold har opdaget strukturen af et enzym, der er afgørende for at opretholde en tilstrækkelig forsyning af DNA-byggesten i menne
Forskere leverer højopløsnings glimt af enzymstrukturVed hjælp af en state-of-the-art type elektronmikroskopi, et MIT-ledet hold har opdaget strukturen af et enzym, der er afgørende for at opretholde en tilstrækkelig forsyning af DNA-byggesten i menne
- Hvordan kan tilførsel af jern til havene bremse den globale opvarmning?
- Hvordan taler Gausss -loven for magnetisme, der generelt bruges, om, hvilke situationer som lukket o…
- Hvor sammenhængende lys kan produceres uden refleksion og brydning?
- Kanariefugle i kulminen:Singapore-veer ringer handelsalarmklokker
- Ekstreme hedebølger sætter søer og floder i varmt vand denne sommer
- Forklarer:Hvad er mikrogravitation?


