Hvad er den længste bølgelængde af lys, der kan forårsage, at en iltbinding i hydrogenperoxid brydes ved hjælp af 210 kJ pr. Mol?
1. Konverter energi til joules pr. Molekyle
* Vi får 210 kJ/mol.
* Avogadros nummer (6.022 x 10²³ molekyler/mol) er konverteringsfaktoren for molekyler til mol.
* Beregn energi pr. Molekyle:
(210 kJ/mol) * (1000 j/kJ)/(6,022 x 10²³ molekyler/mol) =3,49 x 10⁻¹⁹ J/molekyle
2. Brug Planck-Einstein-forholdet
* Planck-Einstein-forholdet forbinder energi (E) og frekvens (v) af lys:E =Hν, hvor H er Plancks konstante (6,626 x 10⁻³⁴ J⋅s).
* Omarranger for at løse for frekvens:v =E/h
* Beregn frekvens:v =(3,49 x 10⁻¹⁹ J) / (6,626 x 10⁻³⁴ J⋅s) =5,27 x 10¹⁴ Hz
3. Beregn bølgelængde
* Forholdet mellem frekvens (v) og bølgelængde (λ) er givet af ligningen:C =νλ, hvor C er lysets hastighed (3,00 x 10⁸ m/s).
* Omarranger for at løse for bølgelængde:λ =c/v
* Beregn bølgelængde:λ =(3,00 x 10⁸ m / s) / (5,27 x 10¹⁴ Hz) =5,69 x 10⁻⁷ m
4. Konverter til nanometre
* 1 meter (m) =10⁹ nanometre (NM)
* Konverter bølgelængde til nanometre:5,69 x 10⁻⁷ m * (10⁹ nm/m) =569 nm
Svar: Den længste bølgelængde af lys, der kan bryde en iltbinding i hydrogenperoxid ved anvendelse af 210 kJ pr. Mol er ca. 569 nm . Dette svarer til grøn Region af det synlige lysspektrum.
Sidste artikelHvad forårsager den lyserøde bundfalning i en løsning?
Næste artikelHvad er produktet af en DNA -synteseaktion?
 Varme artikler
Varme artikler
-
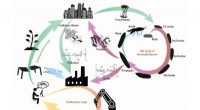 Team udvikler manglende led til cirkulær økonomi, mens de tackler globalt affaldSkematisk over det udviklede lukkede produktionskredsløb baseret på bioinspirerede kitinholdige materialer og biokonvertering i et bymiljø. Kredit:SUTD Forskere fra Singapore University of Technol
Team udvikler manglende led til cirkulær økonomi, mens de tackler globalt affaldSkematisk over det udviklede lukkede produktionskredsløb baseret på bioinspirerede kitinholdige materialer og biokonvertering i et bymiljø. Kredit:SUTD Forskere fra Singapore University of Technol -
 Emissive supramolekylære metallacages via koordinationsdrevet selvsamlingKredit:Pixabay/CC0 Public Domain Metallacager fremstillet via koordineringsdrevet selvmontering har fået stor opmærksomhed på grund af deres tredimensionelle layout og hulrumskernede natur. Konstr
Emissive supramolekylære metallacages via koordinationsdrevet selvsamlingKredit:Pixabay/CC0 Public Domain Metallacager fremstillet via koordineringsdrevet selvmontering har fået stor opmærksomhed på grund af deres tredimensionelle layout og hulrumskernede natur. Konstr -
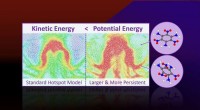 Forskning afdækker manglende fysik i eksplosive hotspotsMolekylær dynamik simuleringer forudsiger, at mere potentiel energi er lokaliseret i hotspots, end deres kinetiske energi (eller temperatur) antyder. Overskydende potentiel energi er bundet til vedvar
Forskning afdækker manglende fysik i eksplosive hotspotsMolekylær dynamik simuleringer forudsiger, at mere potentiel energi er lokaliseret i hotspots, end deres kinetiske energi (eller temperatur) antyder. Overskydende potentiel energi er bundet til vedvar -
 Grøn brint:Forskning for at øge effektivitetenHovedforfatteren til undersøgelsen, Aleksandr Bashkatov fra Institute of Fluid Dynamics. Kredit:HZDR / Stephan Floss Laboratorieeksperimenter og en parabolflyvningskampagne har gjort det muligt fo
Grøn brint:Forskning for at øge effektivitetenHovedforfatteren til undersøgelsen, Aleksandr Bashkatov fra Institute of Fluid Dynamics. Kredit:HZDR / Stephan Floss Laboratorieeksperimenter og en parabolflyvningskampagne har gjort det muligt fo
- Bregner og moser er ens, fordi begge dele?
- Oaseeffekt i byparker kan bidrage til drivhusgasemissioner, undersøgelse finder
- En skovbrugsforsker forklarer, hvordan man vælger det mest bæredygtige juletræ, uanset hvad det e…
- Ny undersøgelse fra undersøger den komplekse verden af afgrødeforsikring
- Grotteforekomster viser overraskende skift i permafrost i løbet af de sidste 400, 000 år
- Dental emalje undersøgelse tyder på forskelle i neandertaler og palæolitisk menneskelig barndom s…


