Hvilken er ikke antagelse om partikler i en gas i henhold til den kinetiske teori?
Antagelser om den kinetiske teori om gasser:
1. Partikler er i konstant, tilfældig bevægelse: Gaspartikler bevæger sig i alle retninger med en række hastigheder, der kolliderer med hinanden og væggene i deres beholder.
2. ubetydelig mængde partikler: Sammenlignet med beholderens volumen betragtes volumenet af de individuelle gaspartikler som ubetydelige.
3. Elastiske kollisioner: Når partikler kolliderer, går ingen energi tabt til friktion eller andre faktorer. Kinetisk energi overføres mellem partikler.
4. Ingen intermolekylære kræfter: Gaspartikler antages at have ubetydelig tiltrækning eller frastødelse mellem dem.
5. Gennemsnitlig kinetisk energi er proportional med temperaturen: Den gennemsnitlige kinetiske energi af gaspartikler er direkte proportional med den absolutte temperatur på gassen.
den ikke-assoat:
Den kinetiske teori antager ikke, at alle partikler har den samme hastighed. I virkeligheden har partiklerne en fordeling af hastigheder. Nogle bevæger sig hurtigere, nogle bevæger sig langsommere, og den gennemsnitlige hastighed er relateret til temperatur.
Nøglepunkt: Mens den kinetiske teori forenkler gassens opførsel, giver den en kraftig ramme for forståelse af gasegenskaber.
Sidste artikelHvilket materiale udgør aske og pimpsten?
Næste artikelHvorfor kan luftvand og isbrud klipper i små fragmenter?
 Varme artikler
Varme artikler
-
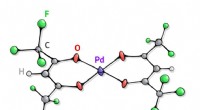 Kemikere accelererede vinylsulfider-reaktionen 10 gangeKatalysatorens opbygning. Kredit:RUDN Universitet Et team af forskere skabte og testede en mere effektiv katalysator til at opnå vinylsulfider. Disse forbindelser kan bruges til udvikling af nye m
Kemikere accelererede vinylsulfider-reaktionen 10 gangeKatalysatorens opbygning. Kredit:RUDN Universitet Et team af forskere skabte og testede en mere effektiv katalysator til at opnå vinylsulfider. Disse forbindelser kan bruges til udvikling af nye m -
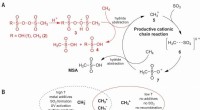 Methanoxidation på plussiden – En selektiv industriel vej til methansulfonsyre(A) Foreslået ionisk reaktionsmekanisme til CH-aktivering af CH4 i den selektive produktion af MSA (methansulfonsyre). (B) Fordele ved den kationiske vej frem for den radikale vej. T, temperatur. Kred
Methanoxidation på plussiden – En selektiv industriel vej til methansulfonsyre(A) Foreslået ionisk reaktionsmekanisme til CH-aktivering af CH4 i den selektive produktion af MSA (methansulfonsyre). (B) Fordele ved den kationiske vej frem for den radikale vej. T, temperatur. Kred -
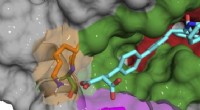 Ny strategi til præcist at målrette undertyper af nøgleproteinRøntgen-co-krystalstruktur af B52-forbindelse (cyan), der binder og hæmmer cyclophilin D-protein. Kredit:Aziz Rangwala Cyclosporin er et af de mest almindelige og effektive immunsuppressive lægemid
Ny strategi til præcist at målrette undertyper af nøgleproteinRøntgen-co-krystalstruktur af B52-forbindelse (cyan), der binder og hæmmer cyclophilin D-protein. Kredit:Aziz Rangwala Cyclosporin er et af de mest almindelige og effektive immunsuppressive lægemid -
 Fleksible faste elektrolytter til hel-solid-state lithium-batterierFotografier af ultratynd Li6.4La3Zr1.4Ta0.6O12-baseret film. Kredit:Qingya Guo, Ningbo Institute of Materials Technology and Engineering Faste elektrolytter af granattypen tiltrækker stor interesse
Fleksible faste elektrolytter til hel-solid-state lithium-batterierFotografier af ultratynd Li6.4La3Zr1.4Ta0.6O12-baseret film. Kredit:Qingya Guo, Ningbo Institute of Materials Technology and Engineering Faste elektrolytter af granattypen tiltrækker stor interesse
- Hvad er den empiriske formel for en forbindelse med molekylær C6H12O6?
- Hvilken oprindelse tilskriver forskere Voynich -manuskriptet, og hvorfor?
- Teslas problem:overvurderer automatisering, undervurderer mennesker
- Generativitet:Unge aktivister motiveres af bekymring for fremtidige generationer
- Hvordan klimaændringer stresser planter og ændrer deres vækst
- Hvorfor det 'solide syd' i amerikansk politik fra midten af århundredet ikke var så solidt


