En forbindelse sammensat af to elementer, der deler valenselektroner?
Her er hvorfor:
* kovalent binding: I kovalent binding deler atomer deres valenselektroner (elektroner i den yderste skal) for at opnå en stabil elektronkonfiguration. Denne deling skaber en stærk attraktion mellem atomerne og holder dem sammen i et molekyle.
* ikke -metaller: Kovalente forbindelser dannes typisk mellem ikke -metaller, da ikke -metaller har en tendens til at få elektroner i stedet for at miste dem. Dette gør deling af elektroner til en mere gunstig mulighed.
Eksempler på kovalente forbindelser:
* vand (H₂O): Hydrogen og ilt deler elektroner til dannelse af et stabilt molekyle.
* kuldioxid (co₂): Carbon deler elektroner med to iltatomer.
* methan (ch₄): Carbon deler elektroner med fire hydrogenatomer.
Fortæl mig, hvis du gerne vil have flere eksempler eller vil udforske specifikke egenskaber ved kovalente forbindelser!
Sidste artikelHvad er reaktionsrækkefølgen af nedbrydning nitrogenpentoxid?
Næste artikelHvordan afhjælper du korrosion?
 Varme artikler
Varme artikler
-
 Kobberstearat lovende til tung olieoxidation, siger undersøgelseKredit:Kazan Federal University Kobbersalte har fundet plads i mange industrier fra lægemidler til landbrug, men de ses sjældent i petrokemi og olieudvinding. Nu, Forskere fra Kazan Federal Univer
Kobberstearat lovende til tung olieoxidation, siger undersøgelseKredit:Kazan Federal University Kobbersalte har fundet plads i mange industrier fra lægemidler til landbrug, men de ses sjældent i petrokemi og olieudvinding. Nu, Forskere fra Kazan Federal Univer -
 Titaniumatom, der findes to steder på én gang i krystal, skyld i usædvanligt fænomenDette højopløselige scanningselektronmikroskop (SEM) billede af BaTiS 3 krystaller er overlejret med illustrationer, der viser orienteringen af individuelle atomer i krystallen. På trods af krysta
Titaniumatom, der findes to steder på én gang i krystal, skyld i usædvanligt fænomenDette højopløselige scanningselektronmikroskop (SEM) billede af BaTiS 3 krystaller er overlejret med illustrationer, der viser orienteringen af individuelle atomer i krystallen. På trods af krysta -
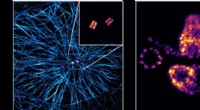 Fremskridt inden for superopløselig mikroskopiTil venstre, en udvidet menneskelig celle med mikrotubuli (blå) og et par centrioler (gul-rød) i midten. Til højre den detaljerede struktur af to udvidede par centrioler. Kredit:Fabian Zwettler / Univ
Fremskridt inden for superopløselig mikroskopiTil venstre, en udvidet menneskelig celle med mikrotubuli (blå) og et par centrioler (gul-rød) i midten. Til højre den detaljerede struktur af to udvidede par centrioler. Kredit:Fabian Zwettler / Univ -
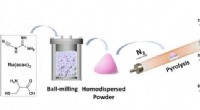 Nye enkelt-atom katalyse støvler reduktiv amineringsreaktionSkematisk illustration til fremstilling af Ru1/NC-T katalysatorer. Kredit:DICP Den geometriske isolering af metalarter i single-atom catalyse (SACer) maksimerer ikke kun atomudnyttelseseffektivite
Nye enkelt-atom katalyse støvler reduktiv amineringsreaktionSkematisk illustration til fremstilling af Ru1/NC-T katalysatorer. Kredit:DICP Den geometriske isolering af metalarter i single-atom catalyse (SACer) maksimerer ikke kun atomudnyttelseseffektivite
- Hvad er definitionen af en regnskov?
- Holografisk farveprint for optisk sikkerhed
- Hvilket molekyle syntetiseres af celler for at give energi?
- At løse fossilt mysterium kan hjælpe Mars med at søge efter liv
- Hvorfor er vand ikke et godt opløsningsmiddel til lipider?
- Sådan bruges Scroll Grid i det Everyday Math Program


