Hvad er reaktionsrækkefølgen af nedbrydning nitrogenpentoxid?
Her er hvorfor:
* rate lov: Renteloven for nedbrydning af n₂o₅ er:
Hastighed =k [n₂o₅]
hvor:
* Hastighed er reaktionshastigheden
* k er hastighedskonstanten
* [N₂O₅] er koncentrationen af nitrogenpentoxid
* Første orden afhængighed: Hastighedsloven viser, at reaktionshastigheden er direkte proportional med koncentrationen af N₂O₅. Dette betyder, at hvis du fordobler koncentrationen af N₂O₅, vil reaktionshastigheden også fordobles. Dette er det definerende egenskab ved en første ordens reaktion.
Eksperimentelt bevis: Den første ordens karakter af denne reaktion er blevet verificeret eksperimentelt gennem forskellige metoder, herunder:
* overvågning af ændringen i koncentration af N₂O₅ over tid: De eksperimentelle data passer til en første ordens integreret sats.
* halveringstid: Halveringstiden for reaktionen er konstant, uanset den indledende koncentration af N₂O₅, som er et andet kendetegn ved en førsteordens reaktion.
 Varme artikler
Varme artikler
-
 Forskere afslører skjult katalytisk overflade af Ni-Au kerneskal i kuldioxidhydrogenering1a) In situ TEM -billedserier; fig. Ib) katalytisk ydeevne; 1c) skematisk illustration Kredit:LIU Wei Årevis, kerne-skal strukturerede partikler er blevet anerkendt som veldesignede katalysatorer,
Forskere afslører skjult katalytisk overflade af Ni-Au kerneskal i kuldioxidhydrogenering1a) In situ TEM -billedserier; fig. Ib) katalytisk ydeevne; 1c) skematisk illustration Kredit:LIU Wei Årevis, kerne-skal strukturerede partikler er blevet anerkendt som veldesignede katalysatorer, -
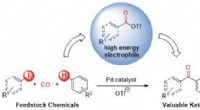 En grønnere måde at lave ketoner påKredit:McGill University Forskere ved McGill University har opdaget en ny, mere miljøvenlig måde at fremstille ketoner på, en vigtig kemisk ingrediens i lægemidler. Mens ketoner findes i en lang r
En grønnere måde at lave ketoner påKredit:McGill University Forskere ved McGill University har opdaget en ny, mere miljøvenlig måde at fremstille ketoner på, en vigtig kemisk ingrediens i lægemidler. Mens ketoner findes i en lang r -
 Motion er godt for din hud:Et protein efterligner nogle antialdringseffekter hos musForskere forstår endnu ikke virkningerne af aldring på de cellulære processer, der er involveret i hudheling. Justin Crane, en assisterende professor i biologi på Northeastern, og Wesley Wong, en fjer
Motion er godt for din hud:Et protein efterligner nogle antialdringseffekter hos musForskere forstår endnu ikke virkningerne af aldring på de cellulære processer, der er involveret i hudheling. Justin Crane, en assisterende professor i biologi på Northeastern, og Wesley Wong, en fjer -
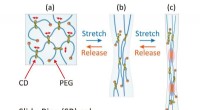 Biokompatible hydrogelmaterialer kan hurtigt komme sig efter mekanisk belastningEn strain gauge trækker prøver af hydrogel fra hinanden. (Øvre) En typisk gel med et hak skåret i venstre side snappede kort tid efter at den var strakt. (Midt) Den nye selvforstærkede gel havde et ha
Biokompatible hydrogelmaterialer kan hurtigt komme sig efter mekanisk belastningEn strain gauge trækker prøver af hydrogel fra hinanden. (Øvre) En typisk gel med et hak skåret i venstre side snappede kort tid efter at den var strakt. (Midt) Den nye selvforstærkede gel havde et ha
- Den kontra-intuitive løsning til at få folk til at bekymre sig om klimaændringer
- At finde måder at fikse klimaet på, før det er for sent
- Badekarringe omkring Titans søer kan være lavet af fremmede krystaller
- Uregelmæssig vind, tørre forhold brænder dødbringende californiske brande
- Sådan fungerer havfruer
- Er ikke-metallodin stærkt reaktivt?


