Hvorfor er KRF2 ikke-polær?
* molekylær geometri: KRF₂ har en lineær molekylær geometri. Dette betyder, at de to fluoratomer er placeret på modsatte sider af Krypton -atomet.
* Elektronegativitetsforskel: Fluor er meget mere elektronegativ end Krypton. Dette betyder, at fluoratomerne trækker de delte elektroner i KR-F-bindingerne tættere på sig selv, hvilket skaber delvis negative ladninger (Δ-) på fluoratomerne og en delvis positiv ladning (Δ+) på Krypton Atom.
* dipolmoment: På grund af den ujævne fordeling af elektrondensitet skabes et permanent dipolmoment. Dette dipolmoment opstår fra vektorsummen af de individuelle bindingsdipoler.
Derfor, selvom KRF₂ har en lineær geometri, resulterer den signifikante elektronegativitetsforskel mellem KR og F -atomer i et polært molekyle.
Sidste artikelEr kulstof det første element i periodisk tabel?
Næste artikelHvordan finder du teoretisk procentdel af vandet?
 Varme artikler
Varme artikler
-
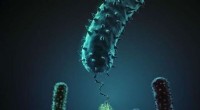 Bakteriel adhæsion in vitro og in silicoDenne figur viser, hvordan stafylokokker adhæsionsprotein (i grønt) interagerer med dets beslægtede peptidligand (rød). Kredit:H. Gaub, LMU München Ludwig-Maximilians-Universitaet (LMU) forskere
Bakteriel adhæsion in vitro og in silicoDenne figur viser, hvordan stafylokokker adhæsionsprotein (i grønt) interagerer med dets beslægtede peptidligand (rød). Kredit:H. Gaub, LMU München Ludwig-Maximilians-Universitaet (LMU) forskere -
 Forskere laver gigantiske molekylære bure til energiomdannelse og medicinafgivelseEt diagram, der viser den molekylære burstruktur. Kredit:Professor Wolfgang Schmitt, Trinity College Dublin Forskere fra Trinity College Dublin og AMBER, det Science Foundation Ireland-finansiered
Forskere laver gigantiske molekylære bure til energiomdannelse og medicinafgivelseEt diagram, der viser den molekylære burstruktur. Kredit:Professor Wolfgang Schmitt, Trinity College Dublin Forskere fra Trinity College Dublin og AMBER, det Science Foundation Ireland-finansiered -
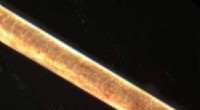 En ny komposit til trækstyrkeStrand af menneskehår ved 200x forstørrelse. Kredit:Jan Homann/Wikipedia Materialeforskere er altid på udkig efter nye kompositter, materialer omfattende to eller flere forskellige stoffer, der ko
En ny komposit til trækstyrkeStrand af menneskehår ved 200x forstørrelse. Kredit:Jan Homann/Wikipedia Materialeforskere er altid på udkig efter nye kompositter, materialer omfattende to eller flere forskellige stoffer, der ko -
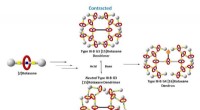 Gennembrud i makromolekylære maskiner til aktivt kontrolleret levering af kræftmedicinMolekylære maskiners kemiske struktur. Kredit:HKBU Forskere fra Hong Kong Baptist University (HKBU) demonstrerede design og syntese af et smart globulært makromolekylært maskinkøretøj til aktivt k
Gennembrud i makromolekylære maskiner til aktivt kontrolleret levering af kræftmedicinMolekylære maskiners kemiske struktur. Kredit:HKBU Forskere fra Hong Kong Baptist University (HKBU) demonstrerede design og syntese af et smart globulært makromolekylært maskinkøretøj til aktivt k
- Når det kommer til falske nyheder, bliver folk, der ønsker kaos, ikke afskrækket af advarsler om …
- Hvilket organ har ingen kendt funktion?
- CERN planlægger at søge efter mystisk femte styrkepartikel
- Hvad er forskellen mellem en sol- og måneformørkelse, hvordan opstår de?
- Forskning finder vendepunkt for storstilet social forandring
- Opdagelse kan forlænge levetiden for elektroniske enheder


