Hvad er sandt med molariteten af en svag syre?
* Molaritet og styrke er forskellige: Molariteten af en svag syre henviser til dens koncentration (mol syre pr. Liter opløsning). Det indikerer ikke direkte, hvor stærk eller svag syren er.
* svage syrer ioniserer ikke helt: I modsætning til stærke syrer, der ioniserer fuldstændigt i opløsning, ioniserer svage syrer kun delvist. Dette betyder, at en betydelig del af syremolekylerne forbliver i deres originale, uudskillede form.
* ligevægt er nøglen: Omfanget af ionisering af en svag syre styres af dens ligevægtskonstant (KA). En lavere Ka -værdi indikerer en svagere syre (mindre ionisering).
* pH og molaritet er relateret, men komplekse: PH af en svag syreopløsning er relateret til dens molaritet, men forholdet er mere komplekst end for stærke syrer. PH afhænger af Ka -værdien og den oprindelige molaritet.
Kortfattet:
* Molariteten af en svag syre fortæller dig, hvor meget syre der er til stede i opløsningen.
* Det fortæller dig ikke, hvor stærk eller svag syren er.
* Styrken af en svag syre bestemmes af dens Ka -værdi og omfanget af dens ionisering.
 Varme artikler
Varme artikler
-
 Kemi baner vejen for forbedrede elektroniske materialerEt tyndt lag indiumnitrid på siliciumcarbid, skabt ved hjælp af molekylet udviklet af forskere ved Linköpings universitet, Sverige. Kredit:Magnus Johansson/Linköpings universitet Indiumnitrid er e
Kemi baner vejen for forbedrede elektroniske materialerEt tyndt lag indiumnitrid på siliciumcarbid, skabt ved hjælp af molekylet udviklet af forskere ved Linköpings universitet, Sverige. Kredit:Magnus Johansson/Linköpings universitet Indiumnitrid er e -
 Kunstig synaptisk enhed simulerer den menneskelige hjernes funktionRepræsentation af neuroner og synapser i den menneskelige hjerne. Den forstørrede synapse repræsenterer den del, der efterlignes ved hjælp af solid-state-enheder. Kredit:Daegu Gyeongbuk Institut for V
Kunstig synaptisk enhed simulerer den menneskelige hjernes funktionRepræsentation af neuroner og synapser i den menneskelige hjerne. Den forstørrede synapse repræsenterer den del, der efterlignes ved hjælp af solid-state-enheder. Kredit:Daegu Gyeongbuk Institut for V -
 Verdens første til at læse digitalt kodede syntetiske molekylerVed at indsætte skrøbelige bindinger mellem hver molekylær byte, digitale polymerer kan let aflæses gennem massespektrometri. Kredit:Jean-François Lutz, Institut Charles Sadron (CNRS) Ved hjælp af
Verdens første til at læse digitalt kodede syntetiske molekylerVed at indsætte skrøbelige bindinger mellem hver molekylær byte, digitale polymerer kan let aflæses gennem massespektrometri. Kredit:Jean-François Lutz, Institut Charles Sadron (CNRS) Ved hjælp af -
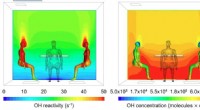 Genovertænker indendørs luftkemiComputermodellering af OH-reaktivitet (venstre) og OH-koncentration (højre) omkring menneskekroppe i en typisk indendørs situation, mens folk sidder omkring et bord. Kredit:UC Irvine Folk bruger ty
Genovertænker indendørs luftkemiComputermodellering af OH-reaktivitet (venstre) og OH-koncentration (højre) omkring menneskekroppe i en typisk indendørs situation, mens folk sidder omkring et bord. Kredit:UC Irvine Folk bruger ty
- Er cystaller af salt virkelig tørre?
- Popcorn-robotik:Cornell-teamet udforskede opvarmede kerner
- Side-by-side afsætning af atomisk flade halvlederplader forbedrer solcellekonverteringseffektivitet…
- Fysikere præsenterer en ny måde at forudsige magnetiske legeringsegenskaber med maskinlæring
- Kvælningsfare:Luftforurening hænger over Asian Games
- Designer den perfekte membran til ren adskillelse af gasser


