Hvad er prikken og krydset for tetrachlormethan?
Her er hvorfor:
* ioniske forbindelser Involver overførsel af elektroner, hvilket fører til dannelse af ioner med modsatte afgifter. Dot- og krydsdiagrammet repræsenterer overførslen af elektroner og de resulterende afgifter.
* kovalente forbindelser Involver deling af elektroner, ikke den komplette overførsel. Denne deling resulterer i dannelsen af kovalente obligationer.
For at repræsentere bindingen i tetrachlormethan ville du bruge en Lewis -struktur:
1. Centralatom: Carbon (c) er det centrale atom.
2. Valenselektroner: Carbon har 4 valenselektroner, og hvert chloratom har 7 valenselektroner.
3. limning: Carbon deler en elektron med hvert af de fire kloratomer, der danner fire enkelt kovalente bindinger (C-CL).
4. ensomme par: Hvert kloratom har tre ensomme par elektroner.
Lewis -strukturen for tetrachlormethan (CCL4) ville se sådan ud:
Cl
|
Cl - C - Cl
|
Cl
Bemærk: Prikkerne repræsenterer valenselektroner for hvert atom, og linjerne repræsenterer de delte elektronpar (kovalente bindinger).
 Varme artikler
Varme artikler
-
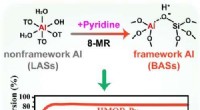 Dynamisk udvikling af aluminiumskoordinationsmiljøer i mordenitzeolitGrafisk abstrakt. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202210658 Zeolitter er vigtige i mange kemiske syntese og petrokemiske processer. De økonomiske og miljømæs
Dynamisk udvikling af aluminiumskoordinationsmiljøer i mordenitzeolitGrafisk abstrakt. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202210658 Zeolitter er vigtige i mange kemiske syntese og petrokemiske processer. De økonomiske og miljømæs -
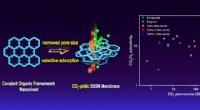 Enfasede kovalente organiske rammemembraner gør CO2-selektiv separation muligIllustration af overlegen CO2-selektiv COF nanosheet membran til højtydende CO2/H2 separation. Kredit:Peng Yuan En forskningsgruppe ledet af prof. Yang Weishen og Dr. Peng Yuan fra Dalian Institut
Enfasede kovalente organiske rammemembraner gør CO2-selektiv separation muligIllustration af overlegen CO2-selektiv COF nanosheet membran til højtydende CO2/H2 separation. Kredit:Peng Yuan En forskningsgruppe ledet af prof. Yang Weishen og Dr. Peng Yuan fra Dalian Institut -
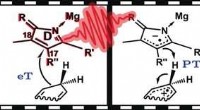 Trinvis hydridoverførsel i biosyntesen af klorofylHydridoverførsel er en vigtig reaktion for kemi (f.eks. brændstofceller), samt biologi (f.eks. respirationskæde og fotosyntese). Tit, en delreaktion involverer overførsel af en hydridion (H−). Men inv
Trinvis hydridoverførsel i biosyntesen af klorofylHydridoverførsel er en vigtig reaktion for kemi (f.eks. brændstofceller), samt biologi (f.eks. respirationskæde og fotosyntese). Tit, en delreaktion involverer overførsel af en hydridion (H−). Men inv -
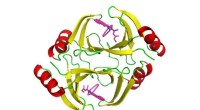 Undersøgelse giver nye spor til forbedring af kemoterapierStrukturen af proteinet kodet af tnmS3-genet. Kredit:Shen Lab/Scripps Research Omkring halvdelen af alle stoffer, lige fra morfin til penicillin, kommer fra forbindelser, der er fra - eller er
Undersøgelse giver nye spor til forbedring af kemoterapierStrukturen af proteinet kodet af tnmS3-genet. Kredit:Shen Lab/Scripps Research Omkring halvdelen af alle stoffer, lige fra morfin til penicillin, kommer fra forbindelser, der er fra - eller er
- Forskere producerer vital komponent i deres søgen efter jordlignende planeter
- De små strukturer, der efterligner cellens naturlige miljø
- Innovativt værktøj tillader kontinentalt vand, energi, og modellering af landsystemer
- De fattigste mennesker er dobbelt så tilbøjelige til at føle sig ensomme i lockdown, sammenlignet…
- Indonesien Go-Jek går ind på markedet i Singapore, udfordringer Grab
- Giftige edderkopper i Madagaskar


