Hvorfor diffusion er maksimal i gasformige tilstand A -stoffer?
1. Store intermolekylære afstande: Gasmolekyler har meget svage intermolekylære kræfter og er langt fra hinanden. Dette betyder, at de har meget fri plads til at bevæge sig rundt.
2. Høj kinetisk energi: Gasmolekyler har høj kinetisk energi på grund af deres konstante tilfældige bevægelse. Denne høje kinetiske energi giver dem mulighed for at bevæge sig hurtigt og dække lange afstande, før de kolliderer med andre molekyler.
3. Ingen fast position: I modsætning til væsker og faste stoffer har gasmolekyler ikke faste positioner og kan bevæge sig frit i alle retninger. Dette giver dem mulighed for at diffundere hurtigt og nemt.
4. Mangel på viskositet: Gasser har meget lav viskositet, hvilket betyder, at de har meget lidt modstand mod flow. Dette gør det muligt for molekylerne at bevæge sig let og sprede sig hurtigt.
5. Høj kompressibilitet: Gasser er meget komprimerbare, hvilket betyder, at deres volumen let kan reduceres ved at anvende tryk. Dette gør det muligt at pakke molekylerne tættere sammen, hvilket øger diffusionshastigheden.
I modsætning:
* væsker: Har stærkere intermolekylære kræfter og er tættere sammen, hvilket begrænser deres bevægelse og diffusionshastighed.
* faste stoffer: Har de stærkeste intermolekylære kræfter og er tæt pakket, hvilket gør diffusion ekstremt langsom.
På grund af deres unikke egenskaber har gasmolekyler derfor den højeste bevægelsesfrihed og udviser således den højeste diffusionshastighed.
Sidste artikelHvad har de fleste atomer en mol guld helium eller bly?
Næste artikelHvad er vand i en vase, der ændres til damp?
 Varme artikler
Varme artikler
-
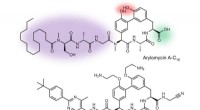 Modificeret arylomycin viste sig at være effektivt mod lægemiddelresistente bakterierKemiske strukturer af arylomycin A-C16 og G0775. Kredit: Natur (2018). DOI:10.1038/s41586-018-0483-6 Et team af forskere, der arbejder på Genentech med bistand fra grupper på RQx Pharmaceuticals
Modificeret arylomycin viste sig at være effektivt mod lægemiddelresistente bakterierKemiske strukturer af arylomycin A-C16 og G0775. Kredit: Natur (2018). DOI:10.1038/s41586-018-0483-6 Et team af forskere, der arbejder på Genentech med bistand fra grupper på RQx Pharmaceuticals -
 Jagt på giftige stoffer i slamSLUDGEFFECT-forskerne undersøger også elektronisk affald. Kredit:Gabriela Castro Varela, NTNU Analytiske kemikere Gabriela Castro Varela og Alexandros Asimakopoulos er på jagt efter giftige og ureg
Jagt på giftige stoffer i slamSLUDGEFFECT-forskerne undersøger også elektronisk affald. Kredit:Gabriela Castro Varela, NTNU Analytiske kemikere Gabriela Castro Varela og Alexandros Asimakopoulos er på jagt efter giftige og ureg -
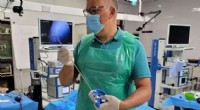 Fremstilling af kirurgiske instrumenter af medicinsk affaldNye styrbare instrumenter til avanceret laparoskopisk kirurgi, delvist lavet af rustfrit stål og blåt polypropylenbetræk, bliver brugt for første gang på Malta. Kredit:Delft University of Technology
Fremstilling af kirurgiske instrumenter af medicinsk affaldNye styrbare instrumenter til avanceret laparoskopisk kirurgi, delvist lavet af rustfrit stål og blåt polypropylenbetræk, bliver brugt for første gang på Malta. Kredit:Delft University of Technology -
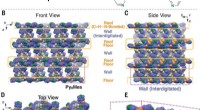 Materiale fremstillet af enkeltmolekyle selvdanner sig til et gitter, der kan helbrede sig selv, lag…Tilstande af C – H ··· N -bindinger i Py åben EMeCN og krystal-pakningsdiagrammer over Pyopen⊃MeCN. (A) Tegninger, der repræsenterer tilstande for C – H ··· N -bindinger i Py åben ⊃MeCN. (B til E)
Materiale fremstillet af enkeltmolekyle selvdanner sig til et gitter, der kan helbrede sig selv, lag…Tilstande af C – H ··· N -bindinger i Py åben EMeCN og krystal-pakningsdiagrammer over Pyopen⊃MeCN. (A) Tegninger, der repræsenterer tilstande for C – H ··· N -bindinger i Py åben ⊃MeCN. (B til E)
- Har ilt en krystal som nitrogen?
- Flod af klager til EU-lande, siden dataloven blev vedtaget
- Nye billeder af asteroideangreb viser påvirkningen 'meget større end forventet'
- Demokratier mere tilbøjelige til at starte krige - undtagen når de ikke er det
- Et Trump-twist? Miljø over økonomi i Michigan
- Hvad er elastisk benstyrke?


