Hvorfor måles KSP kun til salte?
* salte: Disse dannes ved reaktion af en syre og en base, hvilket resulterer i dannelse af en kation fra basen og en anion fra syren.
* metalhydroxider: Disse dannes ved reaktion af en metalkation med hydroxidioner (OH-).
* Metalsulfider: Disse dannes ved reaktion af en metalkation med sulfidioner (S2-).
Hvorfor er KSP specifikt vigtigt for ioniske forbindelser?
Ioniske forbindelser dannes af den elektrostatiske tiltrækning mellem modsat ladede ioner. Når disse forbindelser opløses i vand, adskiller de sig til deres respektive ioner. Opløseligheden af en ionisk forbindelse bestemmes af, i hvilket omfang den adskiller sig i vand.
KSP er et mål for ligevægtskonstant til opløsning af en ionisk forbindelse i vand. Det repræsenterer produktet af koncentrationerne af ionerne i en mættet opløsning.
Eksempel:
Til opløsning af sølvchlorid (AgCl) er ligevægtsreaktionen og KSP -ekspression:
AGCL (s) <=> AG + (aq) + Cl- (aq)
KSP =[AG+] [cl-]
A højere KSP -værdi angiver en højere opløselighed af den ioniske forbindelse. Dette betyder, at flere ioner vil være til stede i opløsningen ved ligevægt.
Afslutningsvis er KSP et værdifuldt værktøj til at forstå opløseligheden af ioniske forbindelser, herunder salte, metalhydroxider og metalsulfider. Det er ikke begrænset til salte alene.
Sidste artikelHvordan raffineres naturgas?
Næste artikelEr elektro plettering af en fysisk eller kemisk ændring?
 Varme artikler
Varme artikler
-
 Engineering ikke-immunceller til at dræbe kræftcellerDen kunstige T-celle genkender en tumorcelle og kobler til den. I processen, antenneproteiner bøjer, som udløser en kædereaktion. Dette fører til drab af tumorcellen. Kredit:ETH Zürich T-celler er
Engineering ikke-immunceller til at dræbe kræftcellerDen kunstige T-celle genkender en tumorcelle og kobler til den. I processen, antenneproteiner bøjer, som udløser en kædereaktion. Dette fører til drab af tumorcellen. Kredit:ETH Zürich T-celler er -
 Hvilke drikkevarer sprænger med umami-potentiale?Kredit:Pixabay/CC0 Public Domain En femte grundsmag er sneget sig ind i vores konceptualisering af fødevarer i de seneste år - umami. på japansk, umami kan groft sagt oversættes til smagfuld lække
Hvilke drikkevarer sprænger med umami-potentiale?Kredit:Pixabay/CC0 Public Domain En femte grundsmag er sneget sig ind i vores konceptualisering af fødevarer i de seneste år - umami. på japansk, umami kan groft sagt oversættes til smagfuld lække -
 Mærkelige ting sker, når en krystal er delt i toEn labyrintlignende struktur opstår på overfladen. Kredit:TU Wien Den bemærkelsesværdige styrke af ioniske krystaller er let forklaret på atomær skala:Positivt og negativt ladede atomer sidder sid
Mærkelige ting sker, når en krystal er delt i toEn labyrintlignende struktur opstår på overfladen. Kredit:TU Wien Den bemærkelsesværdige styrke af ioniske krystaller er let forklaret på atomær skala:Positivt og negativt ladede atomer sidder sid -
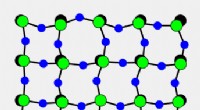 Hemmeligheden bag krystaller, der krymper ved opvarmningDenne animation viser, hvordan faste krystaller af scandiumfluorid krymper ved opvarmning. Mens bindingerne mellem scandium (grøn) og fluoratomer (blå) forbliver relativt stive, fluoratomerne langs si
Hemmeligheden bag krystaller, der krymper ved opvarmningDenne animation viser, hvordan faste krystaller af scandiumfluorid krymper ved opvarmning. Mens bindingerne mellem scandium (grøn) og fluoratomer (blå) forbliver relativt stive, fluoratomerne langs si
- Når Bunsen -brænderen er tændt, men der ikke udføres noget eksperiment, hvorfor det tilrådes at…
- Hvordan svampe var med til at skabe liv, som vi kender det
- Foregår kædereaktion i en atomreaktor?
- Hvordan Manhattan-projektet
- Supercomputersimulering afslører ny mekanisme til membranfusion
- Hvordan påvirker et objekts masse inerti?


