Supercomputersimulering afslører ny mekanisme til membranfusion
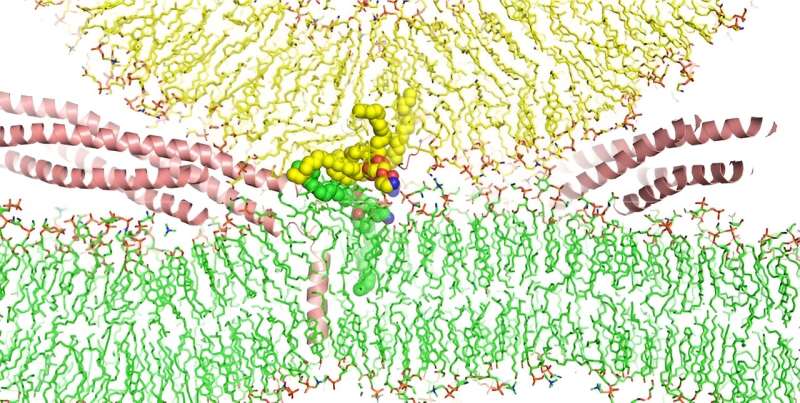
En indviklet simulering udført af forskere fra UT Southwestern Medical Center ved hjælp af en af verdens mest kraftfulde supercomputere kaster nyt lys over, hvordan proteiner kaldet SNARE'er får biologiske membraner til at smelte sammen.
Deres resultater, rapporteret i Proceedings of the National Academy of Sciences , foreslår en ny mekanisme for denne allestedsnærværende proces og kan i sidste ende føre til nye behandlinger for tilstande, hvor membranfusion menes at gå galt.
"Biologi-lærebøger siger, at SNARE'er bringer membraner sammen for at forårsage fusion, og mange mennesker var glade for den forklaring. Men ikke mig, for membraner, der bringes i kontakt, smelter normalt ikke sammen. Vores simulering går dybere for at vise, hvordan denne vigtige proces foregår." sagde studieleder Jose Rizo-Rey ("Josep Rizo"), Ph.D., professor i biofysik, biokemi og farmakologi ved UT Southwestern.
Membranfusion er afgørende for livet. Et typisk eksempel sker i neuroner, celler, der danner grundlaget for nervesystemet og udgør det meste af hjernen, rygmarven og perifere nerver. Disse celler kommunikerer med hinanden ved at frigive kemikalier kaldet neurotransmittere fra vesikler, der skal smelte sammen med den oprindelige neurons cellemembran indefra, for at neurotransmittere kan frigives og genkendes af andre neuroner.
Alle cellulære membraner i eukaryoter - organismer, hvis celler har en membranbundet kerne - er lavet af et dobbeltlag af fosfolipider, molekyler, der har et hoved, der interagerer med vand, og en hale, der frastøder det. Hovederne af disse molekyler danner den indre og ydre foring af membranerne, og halerne er klemt ind imellem. Fosfolipid-dobbeltlagsmembraner omgiver eukaryote celler, deres kerner, mange af deres organeller og nogle andre funktioner, såsom væskefyldte sække kaldet vesikler, der transporterer last i og mellem celler.
Omkring 1990 opdagede forskere, at SNARE'er - en forkortelse for opløselige N-ethylmaleimid-følsomme faktorbindingsproteinreceptorer - spiller en nøglerolle i membranfusion. Den fremherskende forståelse har været, at disse proteiner danner et kompleks, der fungerer som en lynlås, der bringer membraner i tæt kontakt og fører dem til at smelte sammen. Men, forklarede Dr. Rizo-Rey, viste undersøgelser gennem årene, at denne teori havde betydelige huller. For eksempel fik muterede SNARE'er, der stadig bragte membraner i kontakt, dem ikke til at smelte sammen.
For bedre at forstå SNAREs rolle i membranfusion, forsøgte Dr. Rizo-Rey og hans kolleger en anden tilgang. Ved at stole på Frontera – en af verdens hurtigste supercomputere, der er anbragt i Texas Advanced Computing Center ved University of Texas i Austin – kørte holdet en molekylær dynamik-simulering på alle atomer af en vesikel, der fusionerer med et lipid-dobbeltlag, der efterligner neuronale cellemembraner.
Denne type simulering bruger algoritmer til at forudsige, hvordan alle molekylerne i et specifikt system interagerer baseret på de involverede atomers egenskaber - omkring 5,3 millioner atomer i dette tilfælde, hvilket kræver enorm computerkraft at spore.
Denne simulering viste, at snarere end blot at bringe biologiske membraner sammen, inducerer SNARE-komplekset fosfolipider i cellemembranen og vesikler til at vende, og blander deres vandafvisende haler. Denne handling får membranerne til at smelte sammen og efterfølgende danner en pore, der driver vesiklens indhold ud af cellen.
Dr. Rizo-Rey advarede om, at yderligere forskning er nødvendig for at bekræfte, at denne mekanisme forekommer i celler. Han sagde dog, at simuleringens resultater giver meget mening ud fra et fysisk-kemisk synspunkt og passer godt med dem fra flere andre cellefusionsundersøgelser gennem årene.
Selvom der ikke er nogen umiddelbare sundhedsrelaterede implikationer for denne opdagelse, tilføjede han, kan forskere i sidste ende være i stand til at bruge disse resultater til at skabe nye terapier for en række neurologiske sygdomme såsom Alzheimers sygdom, Parkinsons sygdom, skizofreni og epilepsi, tilstande i som nogle eksisterende behandlinger allerede fokuserer på at fremme eller hæmme frigivelse af neurotransmitter.
Diabetes, hjertesygdomme, forhøjet blodtryk, kræft og virusinfektioner afhænger også i høj grad af membranfusion og kan i sidste ende behandles ved at gribe ind i denne proces, sagde Dr. Rizo-Rey.
Flere oplysninger: Josep Rizo et al., Molekylær mekanisme, der ligger til grund for SNARE-medieret membranfusion oplyst af simuleringer af molekylær dynamik med alle atomer, Proceedings of the National Academy of Sciences (2024). DOI:10.1073/pnas.2321447121
Journaloplysninger: Proceedings of the National Academy of Sciences
Leveret af UT Southwestern Medical Center
 Varme artikler
Varme artikler
-
 Hvad du kan gøre for at reducere lysforureningKredit:Pixabay/CC0 Public Domain Som det gamle ordsprog siger, kan mange hænder lave let arbejde. De kan også arbejde sammen for at få lys til at forsvinde. Byens lysforurening er et stort problem
Hvad du kan gøre for at reducere lysforureningKredit:Pixabay/CC0 Public Domain Som det gamle ordsprog siger, kan mange hænder lave let arbejde. De kan også arbejde sammen for at få lys til at forsvinde. Byens lysforurening er et stort problem -
 Saudi -Arabisk klippekunst skildrer snore på forhistoriske hundeNyligt opdagede helleristninger i Saudi -Arabien skildrer forhistoriske hunde i snor. Skærmgreb fra YouTube/Aban Science and Technology af HowStuffWorks. Din hund kan ikke lide at være i snor. Han el
Saudi -Arabisk klippekunst skildrer snore på forhistoriske hundeNyligt opdagede helleristninger i Saudi -Arabien skildrer forhistoriske hunde i snor. Skærmgreb fra YouTube/Aban Science and Technology af HowStuffWorks. Din hund kan ikke lide at være i snor. Han el -
 Ny forskning fremhæver behovet for at lære af tidligere klimaændringerKredit:University of Manchester Ny international forskning ledet af University of Manchester har fremhævet, at læring fra tidligere perioder med klimaændringer er afgørende, hvis vi skal forstå ar
Ny forskning fremhæver behovet for at lære af tidligere klimaændringerKredit:University of Manchester Ny international forskning ledet af University of Manchester har fremhævet, at læring fra tidligere perioder med klimaændringer er afgørende, hvis vi skal forstå ar -
 Sådan fungerer Jet LagJetlag gør ondt. Se mere få flere søvnbilleder. iStockphoto.com/Thinkstock Hvis du har planer om at tage en lang tur, der involverer at flyve over flere tidszoner, du frygter måske allerede det udmat
Sådan fungerer Jet LagJetlag gør ondt. Se mere få flere søvnbilleder. iStockphoto.com/Thinkstock Hvis du har planer om at tage en lang tur, der involverer at flyve over flere tidszoner, du frygter måske allerede det udmat
- Hvordan man laver elektricitetsflow som lyn mellem to metalstænger
- Sociale medier fremskynder trolling - se bare på Raygun. Hvordan kan vi stoppe virale øjeblikke i …
- Undersøgelse finder ud af, at der kan undervises i etik - i finans, i det mindste
- Hvilke organer hjælper den menneskelige krop med at slippe af med affald produceret af celler?
- Jagter nanoplastik
- Udforsker, hvordan antibiotika-resistente bakterier bliver aggressive


