Hvordan påvirker volumentemperaturen og densiteten gastrykket?
1. Volumen
* Inverse forhold: Tryk og volumen har et omvendt forhold. Dette er beskrevet af Boyle's Law :
* Ved konstant temperatur er trykket fra en gas omvendt proportionalt med dens volumen.
* Eksempel: Hvis du reducerer volumenet af en gasbeholder med halvdelen, vil trykket fordobles.
2. Temperatur
* Direkte forhold: Tryk og temperatur har et direkte forhold. Dette er beskrevet af Gay-Lussacs lov :
* Ved konstant volumen er trykket fra en gas direkte proportionalt med dens absolutte temperatur (målt i Kelvin).
* Eksempel: Hvis du øger temperaturen på en gasbeholder, øges trykket proportionalt.
3. Densitet
* Direkte forhold: Tryk og densitet har et direkte forhold. Dette skyldes, at densitet er direkte relateret til antallet af gasmolekyler pr. Enhedsvolumen. Flere molekyler betyder flere kollisioner med containervæggene, hvilket fører til højere tryk.
* Eksempel: Forøgelse af tætheden af en gas ved at tilsætte flere molekyler (ved konstant volumen og temperatur) øger trykket.
Nøglekoncepter:
* kinetisk molekylær teori: Denne teori forklarer gassens opførsel. Den siger, at gasmolekyler er i konstant tilfældig bevægelse og kolliderer med hinanden og væggene i deres beholder. Disse kollisioner skaber pres.
* Ideel gaslov: Denne lov kombinerer Boyle's lov, Gay-Lussacs lov, og Avogadros lov til en enkelt ligning:PV =NRT. Hvor:
* P =tryk
* V =volumen
* n =antal mol gas
* R =ideel gaskonstant
* T =temperatur (i Kelvin)
Kortfattet:
* faldende volumen øger trykket.
* stigende temperatur øger trykket.
* stigende densitet øger trykket.
Vigtig note: Disse forhold gælder for ideelle gasser. Ægte gasser kan afvige fra ideel opførsel ved højt tryk og lave temperaturer.
 Varme artikler
Varme artikler
-
 Robotter aktiveret af vand kan være den næste grænseNy forskning fra laboratoriet i Ozgur Sahin, lektor i biologiske videnskaber og fysik ved Columbia University, viser, at materialer kan fremstilles til at skabe bløde aktuatorer - enheder, der konvert
Robotter aktiveret af vand kan være den næste grænseNy forskning fra laboratoriet i Ozgur Sahin, lektor i biologiske videnskaber og fysik ved Columbia University, viser, at materialer kan fremstilles til at skabe bløde aktuatorer - enheder, der konvert -
 De smukkeste solceller er inspireret af naturenVi tror på, at disse solceller har en fremtid, og kemien er utrolig spændende, ” siger Audun Formo Buene. Kredit:Per Henning, NTNU Organiske solceller er normalt mindre effektive end siliciumsolce
De smukkeste solceller er inspireret af naturenVi tror på, at disse solceller har en fremtid, og kemien er utrolig spændende, ” siger Audun Formo Buene. Kredit:Per Henning, NTNU Organiske solceller er normalt mindre effektive end siliciumsolce -
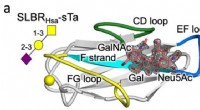 Udnyttelse af strukturen af bakterielle værtscellereceptorer til at påvise cancerKrystalstruktur af en streptococcus SLBR (Hsa) binding med høj affinitet til værtscellens glycanreceptor (sTa). Variation i sekvens og struktur af de mærkede SLBR-proteinsløjfer (CD, EF og FG) forudsi
Udnyttelse af strukturen af bakterielle værtscellereceptorer til at påvise cancerKrystalstruktur af en streptococcus SLBR (Hsa) binding med høj affinitet til værtscellens glycanreceptor (sTa). Variation i sekvens og struktur af de mærkede SLBR-proteinsløjfer (CD, EF og FG) forudsi -
 Almindelig ingrediens i husholdningsprodukter kan bidrage til antibiotikaresistensHolly Barrett, en ph.d.-kandidat i afdelingen for kemi, ledede en undersøgelse, der viste, at triclosan, der findes i mange almindelige husholdningsprodukter, er det fremherskende antibiotikum i Ontar
Almindelig ingrediens i husholdningsprodukter kan bidrage til antibiotikaresistensHolly Barrett, en ph.d.-kandidat i afdelingen for kemi, ledede en undersøgelse, der viste, at triclosan, der findes i mange almindelige husholdningsprodukter, er det fremherskende antibiotikum i Ontar
- Lille, men selvpålagt:Titanium ændrer værtsgitteratoms adfærd
- Forståelse af kulstofnanorørs forstærkende evne
- Ny online database bringer genomet i fokus ved hjælp af molekylær struktur
- Sjældent kort fundet på et loft giver et ekstraordinært indblik i livet i det 18. århundrede
- Hvad er anvendelsen af teknik til levende ting?
- Brain Model Ideas


