Hvilke slags reaktioner er røde oxreaktioner?
* redox er en forkortet betegnelse for reduktionsoxidation .
* reduktion er gevinsten af elektroner.
* Oxidation er tabet af elektroner.
Nøgleegenskaber ved redoxreaktioner:
* Ændring i oxidationstilstande: Oxidationstilstanden for mindst et element involveret i reaktionsændringerne.
* Elektronoverførsel: Elektroner overføres fra en art til en anden.
* forekommer altid sammen: Reduktion og oxidation sker altid samtidig i en reaktion.
Eksempler på redoxreaktioner:
* forbrænding: Forbrænding af brændstoffer som træ eller propan involverer oxidation af brændstof og reduktion af ilt.
* Korrosion: Rusten af jern er en redoxreaktion, hvor jern oxideres til jernoxid.
* elektrolyse: Processen med at bruge elektricitet til at nedbryde en forbindelse (som vand i brint og ilt) involverer redoxreaktioner.
* Batteri drift: Batterier fungerer ved redoxreaktioner, hvor elektroner strømmer fra en elektrode til en anden gennem et eksternt kredsløb.
Kortfattet: Redox -reaktioner er grundlæggende for mange kemiske processer i natur og teknologi, der spiller en afgørende rolle i alt fra energiproduktion til biologiske processer.
Sidste artikelHvor kan vi finde ikke -metaller i verden?
Næste artikelEr alle molekyler af livskulstofbaseret?
 Varme artikler
Varme artikler
-
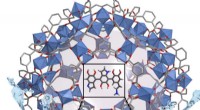 Fjernelse af tungmetaller fra vand med MOF'erEn organisk metalramme kan fjerne bly fra vandprøver, få dem til EPA-godkendte niveauer på få sekunder. Kredit:American Chemical Society Det anslås, at 1 milliard mennesker ikke har adgang til ren
Fjernelse af tungmetaller fra vand med MOF'erEn organisk metalramme kan fjerne bly fra vandprøver, få dem til EPA-godkendte niveauer på få sekunder. Kredit:American Chemical Society Det anslås, at 1 milliard mennesker ikke har adgang til ren -
 Forskere rapporterer om ny klasse af polyethylenkatalysatorerOlafs Daugulis, Robert A. Welch Chair of Chemistry ved University of Houston, ledet et team, der opdagede en ny klasse af katalysatorer til fremstilling af ultra-højvægts polyethylen. Kredit:Universit
Forskere rapporterer om ny klasse af polyethylenkatalysatorerOlafs Daugulis, Robert A. Welch Chair of Chemistry ved University of Houston, ledet et team, der opdagede en ny klasse af katalysatorer til fremstilling af ultra-højvægts polyethylen. Kredit:Universit -
 Nyt lægemiddel kunne forhindre invaliderende bivirkning af kræftbehandlingPladsfyldende struktur skildring af GC4419 baseret på røntgenkrystalstrukturbestemmelse. Kredit:Dennis Riley Omkring 50, 000 mennesker i USA diagnosticeres årligt med hoved, nakke, kræft i næsen o
Nyt lægemiddel kunne forhindre invaliderende bivirkning af kræftbehandlingPladsfyldende struktur skildring af GC4419 baseret på røntgenkrystalstrukturbestemmelse. Kredit:Dennis Riley Omkring 50, 000 mennesker i USA diagnosticeres årligt med hoved, nakke, kræft i næsen o -
 Hurtigere, grønnere måde at producere kulstofkugler påKulissfærer - mikroskopbilleder Hurtig, grøn og et-trins metode til fremstilling af porøse kulstofkugler, som er en vital komponent for kulstoffangstteknologi og for nye måder at lagre vedvarende ener
Hurtigere, grønnere måde at producere kulstofkugler påKulissfærer - mikroskopbilleder Hurtig, grøn og et-trins metode til fremstilling af porøse kulstofkugler, som er en vital komponent for kulstoffangstteknologi og for nye måder at lagre vedvarende ener
- Gennemsigtigt jern? For første gang viser et eksperiment, at atomkerner kan blive gennemsigtige
- CAR T-behandlinger kan have færre bivirkninger end andre kræftimmunterapier
- Hvordan fjernsyn fungerer
- Er gifte mennesker lykkeligere end singler?
- Tres australske aviser stopper med at trykke
- Forsteningsprocessen af dinosaurer er tilbage


