Hvor mange måder er der for at udtrykke de relative mængder af opløst stof og opløsningsmiddel i opløsning?
1. Koncentration:
* Molaritet (M): Mol opløst stof pr. Liter opløsning.
* molalitet (m): Mol opløst stof pr. Kg opløsningsmiddel.
* Normalitet (n): Gramækvivalente vægte af opløst stof pr. Liter opløsning.
* dele pr. million (ppm): Milligrams opløst stof pr. Liter opløsning.
* dele pr. milliard (ppb): Mikrogram med opløst stof pr. Liter opløsning.
* vægt/volumenprocent (% w/v): Gram opløst stof pr. 100 ml opløsning.
* volumen/volumenprocent (% vol/vol): Ml opløst stof pr. 100 ml opløsning.
* vægt/vægtprocent (% w/w): Gram opløst stof pr. 100 g opløsning.
* molfraktion (χ): Mol af opløst stof divideret med den samlede mol opløst stof og opløsningsmiddel.
2. Andre foranstaltninger:
* Masse/volumenforhold: Massen af det opløste stof divideret med mængden af opløsningen.
* opløst-til-opløsningsmiddelforhold: Forholdet mellem masse eller mængden af opløst stof og masse eller volumen af opløsningsmidlet.
* densitet: Massen af opløsningen pr. Enhedsvolumen.
3. Mætning:
* mættet løsning: En løsning, der indeholder den maksimale mængde opløst opløst stof ved en given temperatur.
* Umættet løsning: En løsning, der indeholder mindre end den maksimale mængde opløst opløst stof ved en given temperatur.
* overmættet løsning: En løsning, der indeholder mere end den maksimale mængde opløst opløst stof ved en given temperatur.
Den bedste måde at udtrykke de relative mængder af opløst stof og opløsningsmiddel afhænger af den specifikke anvendelse og det ønskede præcisionsniveau.
Sidste artikelHvad kan du sige om gassen inde i en ballon?
Næste artikelHvilken slags stof flyder i olie?
 Varme artikler
Varme artikler
-
 Titan-i-et-glas-eksperimenter antyder mineralsammensætning af Saturn-månenÆgte farvebillede af lag af dis i Titans atmosfære. Kredit:NASA Titan, Saturns største måne, er et naturligt laboratorium til at studere livets oprindelse. Ligesom Jorden, Titan har en tæt atmosfæ
Titan-i-et-glas-eksperimenter antyder mineralsammensætning af Saturn-månenÆgte farvebillede af lag af dis i Titans atmosfære. Kredit:NASA Titan, Saturns største måne, er et naturligt laboratorium til at studere livets oprindelse. Ligesom Jorden, Titan har en tæt atmosfæ -
 Guld nanopartikler til at finde anvendelser i brintøkonomiDen internationale videnskabelige gruppe udførte forsøget med halvleder baseret på titaniumdioxid. Kredit:Peter den Store St.Petersburg Polytechnic University Et internationalt hold af videnskabsm
Guld nanopartikler til at finde anvendelser i brintøkonomiDen internationale videnskabelige gruppe udførte forsøget med halvleder baseret på titaniumdioxid. Kredit:Peter den Store St.Petersburg Polytechnic University Et internationalt hold af videnskabsm -
 Ny overfladebehandling kan forbedre køleeffektivitetenEn glat overflade til væsker med meget lav overfladespænding fremmer dråbedannelse, lette varmeoverførslen. Kredit:Karim Khalil et al . I modsætning til vand, flydende kølemidler og andre væsk
Ny overfladebehandling kan forbedre køleeffektivitetenEn glat overflade til væsker med meget lav overfladespænding fremmer dråbedannelse, lette varmeoverførslen. Kredit:Karim Khalil et al . I modsætning til vand, flydende kølemidler og andre væsk -
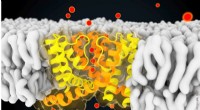 Strukturelle og dynamiske forskelle mellem selektive og ikke-selektive ionkanalerSnapshot taget under computersimuleringen af NaK-kanalen - Denne kanal (vist i gult og orange) muliggør strømmen af ioner (f.eks. kaliumioner [røde kugler]) over cellemembranen. (Membranlipiderne
Strukturelle og dynamiske forskelle mellem selektive og ikke-selektive ionkanalerSnapshot taget under computersimuleringen af NaK-kanalen - Denne kanal (vist i gult og orange) muliggør strømmen af ioner (f.eks. kaliumioner [røde kugler]) over cellemembranen. (Membranlipiderne
- Hvad sker der med relativ fugtighed, når lufttemperaturen stiger?
- Er masse og volumen en kemisk egenskab?
- Kunne en skaldet ørn og vingård blokere foreslået stenbrud langs Boise-floden?
- Endimensionelt materiale er et kraftfuldt slag til næste generations elektronik
- Nytænkning af turisme og dens bidrag til bevaring i New Zealand
- Er mindre mere? Sådan ser forbrugerne på bæredygtighedskrav


