Hvor meget gram kobber i 1 kg sulfat?
Her er hvorfor:
* sulfat er en polyatomisk ion (so₄²⁻). Det danner salte med forskellige metaller.
* kobbersulfat (Cuso₄) er kun et eksempel. Andre inkluderer natriumsulfat (Na₂so₄), kaliumsulfat (K₂so₄) og magnesiumsulfat (MGSO₄), hver med et andet kobberindhold.
For at beregne kobberens gram i 1 kg sulfat skal du vide:
1. den specifikke type sulfat: Er det for eksempel kobbersulfat (cuso₄)?
2. molekylvægten af sulfat: Dette fortæller dig, at andelen af kobber i forbindelsen.
Sådan beregnes det, når du først har disse oplysninger:
1. Find sulfatets molekylvægt: Du kan finde dette i en periodisk tabel eller en kemisk lærebog.
2. Find atomvægten af kobber: Dette er også tilgængeligt i en periodisk tabel.
3. Beregn procentdelen af kobber ved masse i sulfatet: Opdel kobberets atomvægt med sulfatets molekylvægt og multiplicer med 100%.
4. Multiplicer procentdelen af kobber med sulfatens masse: Dette giver dig gram af kobber i prøven.
Eksempel:
Lad os sige, at du vil finde gram af kobber i 1 kg kobbersulfat (cuso₄):
1. molekylvægt af cuso₄ =63,55 (Cu) + 32,06 (s) + 4 * 16,00 (O) =159,61 g/mol
2. atomvægt af kobber (Cu) =63,55 g/mol
3. procentdel af kobber i cuso₄ =(63,55 / 159,61) * 100% =39,81%
4. gram kobber i 1 kg cuso₄ =0,3981 * 1000 g =398,1 g
Derfor er der cirka 398,1 gram kobber i 1 kg kobbersulfat.
Sidste artikelHvad har stof og blanding til fælles?
Næste artikelVil Cu erstatte H fra H2SO4?
 Varme artikler
Varme artikler
-
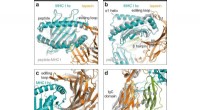 Molekylære chaperoninteraktioner visualiseret gennem røntgenstrukturanalyseKonformationelle ændringer ved klient-chaperone engagement. et topbillede af superpositionering af peptid-receptiv MHC I i chaperonkomplekset (MHC I hc, teal; tapasin, orange) med peptidbundet H2-Db (
Molekylære chaperoninteraktioner visualiseret gennem røntgenstrukturanalyseKonformationelle ændringer ved klient-chaperone engagement. et topbillede af superpositionering af peptid-receptiv MHC I i chaperonkomplekset (MHC I hc, teal; tapasin, orange) med peptidbundet H2-Db ( -
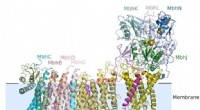 Mikrober fra marine vulkanske ventilationsåbninger afslører, hvordan mennesker tilpassede sig en æ…MBH strukturen. Kredit:Huilin Li, Ph.D., Michael W.W. Adams &Hongjun Yu, Ph.d. Gamle mikrober, der trives i nogle af verdens mest ekstreme miljøer og nutidens mennesker, har mere tilfælles end man
Mikrober fra marine vulkanske ventilationsåbninger afslører, hvordan mennesker tilpassede sig en æ…MBH strukturen. Kredit:Huilin Li, Ph.D., Michael W.W. Adams &Hongjun Yu, Ph.d. Gamle mikrober, der trives i nogle af verdens mest ekstreme miljøer og nutidens mennesker, har mere tilfælles end man -
 Åbning af nye døre:Første syntetiske mekanofølsomme kaliumkanalKredit:Kohei Sato, Tokyo Institute of Technology Forbløffet af egenskaberne af ionkanalproteiner, der almindeligvis observeres i celler, har Tokyo Tech-forskere udviklet den første syntetiske mekan
Åbning af nye døre:Første syntetiske mekanofølsomme kaliumkanalKredit:Kohei Sato, Tokyo Institute of Technology Forbløffet af egenskaberne af ionkanalproteiner, der almindeligvis observeres i celler, har Tokyo Tech-forskere udviklet den første syntetiske mekan -
 Forskere skaber 3D-printede, mikroskopiske gassensorer:Malerpaller uden et strejf af pigment3D-printet mikroskopisk gassensor. Midt:Foto af glassubstratet, der viser den farverige 3D-printede sensor. Venstre:Zoomede optiske mikroskopibilleder, der viser den pixelerede sensor som reaktion på
Forskere skaber 3D-printede, mikroskopiske gassensorer:Malerpaller uden et strejf af pigment3D-printet mikroskopisk gassensor. Midt:Foto af glassubstratet, der viser den farverige 3D-printede sensor. Venstre:Zoomede optiske mikroskopibilleder, der viser den pixelerede sensor som reaktion på
- Hvordan er vandgas tilberedt?
- Hvornår udløses kerne sammenbrudfase i slutningen af livet en massiv stjerne?
- Video:SOHOs visning af solstormen den 11. maj 2024
- Er natten mørk på grund af tyk sky, der dækker sol?
- Hvor indflydelsesrige er kollegers reaktioner på opslag på Facebooks nyhedskanaler?
- Fremme efterforskning af kriminalitetsrelaterede dødsfald i vand


