Molekylære chaperoninteraktioner visualiseret gennem røntgenstrukturanalyse
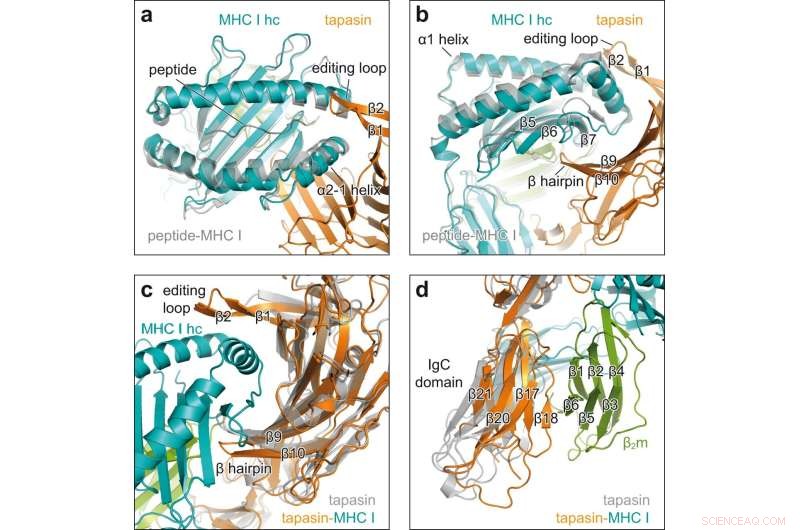
Konformationelle ændringer ved klient-chaperone engagement. et topbillede af superpositionering af peptid-receptiv MHC I i chaperonkomplekset (MHC I hc, teal; tapasin, orange) med peptidbundet H2-D b (grå, PDB ID 2F74) i tegneserierepræsentation. hc tung kæde; β1, β2, β strenge af redigeringsløkke af tapasin. b Set fra siden af superpositionen vist i en β5-, β6-, β7-, β-strenge af MHC I hc; β9, β10, β hårnål af tapasin. c Se på den konkave grænseflade af tapasin i superposition af MHC I-bundet tapasin fra chaperonkomplekset (tapasin, orange; MHC I hc, blågrøn; β2m, grøn) med klientfrit tapasin (grå, PDB ID 3F8U). d Superposition som i c, men set på det C-terminale domæne af tapasin. IgC domæne immunoglobulin konstant domæne, β2 m β2 -mikroglobulin. Kredit:Nature Communications (2022). DOI:10.1038/s41467-022-32841-9
Som task forces af det adaptive immunsystem er T-lymfocytter ansvarlige for at angribe og dræbe inficerede eller kræftceller. Sådanne celler, som næsten alle celler i den menneskelige krop, præsenterer på deres overflade fragmenter af alle de proteiner, de producerer indeni. Hvis disse omfatter peptider, som en T-lymfocyt genkender som fremmede, aktiveres lymfocytten og dræber den pågældende celle.
Det er derfor vigtigt for et robust T-cellerespons, at egnede proteinfragmenter præsenteres for T-lymfocytten. Forskerholdet ledet af Simon Trowitzsch og Robert Tampé fra Institut for Biokemi ved Goethe Universitet Frankfurt har nu kastet lys over, hvordan cellen udvælger disse proteinfragmenter eller peptider.
Peptidpræsentation finder sted på såkaldte major histocompatibility complex klasse I molekyler (MHC I). MHC I-molekyler er en gruppe af meget forskellige overfladeproteiner, der kan binde myriader af forskellige peptider. De er forankret i cellemembranen og danner en peptidbindende lomme med deres udadvendte del.
Som alle overfladeproteiner tager MHC I-molekyler den såkaldte sekretoriske vej:de syntetiseres ind i cellens hulrumssystem (endoplasmatisk retikulum (ER) og Golgi-apparat) og foldes der. Små vesikler knopper derefter ud fra hulrumssystemet, migrerer til cellemembranen og smelter sammen med den.
Modningsprocessen for MHC I-molekylerne er meget strengt kontrolleret:i ER hjælper proteiner kendt som "chaperones" dem med at folde. Chaperone-tapasinet er essentielt for peptidladning i denne proces.
"Når et MHC I-molekyle har bundet et peptid, tjekker tapasin, hvor tæt bindingen er," siger Trowitzsch og forklarer chaperonens opgave. "Hvis bindingen er ustabil, fjernes peptidet og erstattes af et tæt bindende." Det har dog endnu ikke været muligt at afklare, hvordan tapasin præcist udfører denne opgave – især fordi indlæsningsprocessen er ekstremt hurtig.
Biokemikerne og strukturbiologerne fra Goethe Universitet Frankfurt er nu for første gang lykkedes med at visualisere den kortvarige interaktion mellem chaperone og MHC I-molekyle ved hjælp af røntgenstrukturanalyse.
For at gøre dette producerede de varianter af de to interaktionspartnere, der ikke længere var indlejret i membranen, rensede dem og bragte dem sammen. Et trick hjalp med at fange ladningskomplekset i aktion til krystallisering:Først indlæste forskerholdet MHC I-molekylet med et højaffinitetspeptid, så et stabilt kompleks blev skabt.
Et lyssignal udløste spaltning af peptidet, hvilket i høj grad reducerede dets evne til at binde MHC I-molekylet. Med det samme kom tapasin ind i scenen og forblev bundet til MHC I-molekylet, der mangler sit peptid. "Den foto-inducerede spaltning af peptidet var afgørende for succesen af vores eksperiment," siger Tampé. "Ved hjælp af denne optokemiske biologi kan vi nu systematisk reproducere komplekse cellulære processer en efter en."
Røntgenstrukturanalyse af krystallerne afslørede, hvordan tapasin udvider den peptidbindende lomme i MHC I-molekylet og derved tester styrken af peptidbindingen. Til dette formål danner interaktionspartnerne et stort kontaktområde; for stabilisering sidder en løkke af tapasin oven på den udvidede bindingslomme.
"Det er første gang, vi har vist processen med at indlæse i høj opløsning," siger Tampé. Billederne afslører også, hvordan en enkelt chaperone kan interagere med den enorme mangfoldighed af MHC I-molekyler, siger biokemikeren. "Tapasin binder præcist de ikke-variable områder af MHC I-molekylerne." Den nye struktur forbedrer imidlertid ikke kun vores forståelse af de komplekse processer, der er involveret i lastning af MHC I-molekyler. Det bør også hjælpe med at udvælge egnede kandidater til vaccineudvikling.
Forskningen blev offentliggjort i Nature Communications . + Udforsk yderligere
Vejskilte til immunforsvarsceller
 Varme artikler
Varme artikler
-
 Nye biokompatible hybridhydrogeler med imponerende mekaniske egenskaberFigur 1:SAXS -opsætningen på I22. Kredit:Diamond lyskilde For første gang er der skabt en familie af hydrogeler, med unikke egenskaber, der gør det muligt at bruge dem i biologiske applikationer.
Nye biokompatible hybridhydrogeler med imponerende mekaniske egenskaberFigur 1:SAXS -opsætningen på I22. Kredit:Diamond lyskilde For første gang er der skabt en familie af hydrogeler, med unikke egenskaber, der gør det muligt at bruge dem i biologiske applikationer. -
 Principper for dampdestillationDampdestillation fjerner forurenende stoffer fra vandet for at gøre det i det væsentlige inert. Laboratorier og teknikere bruger destilleret vand af denne grund, da det ikke tilføjer noget til den
Principper for dampdestillationDampdestillation fjerner forurenende stoffer fra vandet for at gøre det i det væsentlige inert. Laboratorier og teknikere bruger destilleret vand af denne grund, da det ikke tilføjer noget til den -
 Er sur regn skadeligt for dyr?Acid regn er nedbør, der indeholder salpetersyre og svovlsyrer. Mens nogle naturlige forekomster som vulkaner og rådnende vegetation bidrager til disse syrer, er det den menneskelige aktivitet ved
Er sur regn skadeligt for dyr?Acid regn er nedbør, der indeholder salpetersyre og svovlsyrer. Mens nogle naturlige forekomster som vulkaner og rådnende vegetation bidrager til disse syrer, er det den menneskelige aktivitet ved -
 Forskere designer molekylær system til kunstig fotosynteseFotosystemer (PS) I og II er store proteinkomplekser, der indeholder lysabsorberende pigmentmolekyler, der er nødvendige for fotosyntese. PS II fanger energi fra sollys for at udtrække elektroner fra
Forskere designer molekylær system til kunstig fotosynteseFotosystemer (PS) I og II er store proteinkomplekser, der indeholder lysabsorberende pigmentmolekyler, der er nødvendige for fotosyntese. PS II fanger energi fra sollys for at udtrække elektroner fra
- PSA's bestyrelse godkender Fiat-Chrysler-fusion:kilde
- Verdens første kommercielle nanostrukturerede bulkmetal
- Planck finder ingen nye beviser for kosmiske anomalier
- Nulemissionsdieselforbrænding ved hjælp af et ikke-ligevægtsplasma-assisteret MnO2-filter
- Menneskelige rester fra Mary Rose viser mangfoldigheden af Tudor-besætningen
- Nanoelektronik kunne få et løft fra kulstofforskning


