Elektrisk fosfatsignatur hjælper med at registrere vigtige cellulære hændelser

Grafisk abstrakt. Kredit:Tokyo Tech
Hver dag forekommer millioner af biologiske processer i vores krop på cellulært niveau. At studere disse processer kan hjælpe os med at lære mere om, hvordan celler fungerer, et felt, der er blevet ved med at fascinere forskere. For nylig er der dog kommet en ny spiller på dette felt. En ny analytisk metode - enkeltmolekyle-detektion - har taget fart på grund af dens succes med at observere specifikke, biologisk relevante molekyler og de processer, der er forbundet med dem.
Forskere har prøvet måder at bruge enkelt-molekyle detektionsassays til at studere proteiner og deres post-translationelle modifikationer (PTM'er). PTM'er er enzymatiske ændringer observeret efter proteinsyntese, hvor funktionelle grupper føjes til aminosyrerne i proteinet, hvilket gør det i stand til at udføre en specifik funktion.
Studiet af PTM'er kan hjælpe os med at forstå cellesignalering og oprindelsen af flere sygdomme. Assays, der sigter på at gøre det, skal imidlertid være meget selektive og specifikke for det pågældende protein. I betragtning af de nuværende teknikkers manglende følsomhed er det udfordrende at opnå enkelt-molekyle PTM-målinger.
For nylig har forskere ved Tokyo Institute of Technology (Tokyo Tech) fundet en "elektrificerende" måde at overvinde disse begrænsninger på. I deres nylige gennembrud, offentliggjort i Journal of the American Chemical Society , rapporterede et team af forskere ledet af lektor Tomoaki Nishino fra Tokyo Tech enkeltmolekyle-detektion af fosforylering i peptider - korte aminosyrekæder - og dannelsen af en orthophosphatforbindelse ved hjælp af elektroniske signaturer.
Dr. Nishino forklarer, "Vi valgte peptidphosphorylering, en arketypisk og biologisk relevant PTM, til vores påvisningsundersøgelser. Målet var at udvikle et værktøj, der kunne detektere selv den mindste ændring i den kemiske struktur af aminosyrer."
Til at starte med studerede holdet de elektroniske egenskaber af fosforylerede peptider ved hjælp af deres uorganiske analog, orthophosphorsyre (H3 PO4 ). De fremstillede en fosfatopløsning (PO4 3- ) og underkastede det en scanning tunneling microscope (STM)-assisteret break-junction (BJ) teknik. Når strømmen blev ført mellem to guld STM-elektroder, blev en orthophosphatgruppe fundet at bygge bro over nanogabet mellem elektroderne ved at danne en stabil forbindelse på grund af interaktionen mellem dens negativt ladede oxygenatomer med guldet. Det var dette kryds og dets signatur, der drev yderligere eksperimenter.
Enkeltorthofosfatforbindelsen viste sig at have en høj ledningsevne på 0,4 G0 og særskilte elektroniske egenskaber, hvoraf sidstnævnte gjorde det muligt for denne procedure at være meget specifik og nøjagtigt at aflæse den pågældende PTM (dvs. phosphorylering). For yderligere at teste deres teknik udførte holdet in situ enkeltmolekyle phosphoryleringsassays, hvor de var i stand til at skelne mellem phosphorylerede og ikke-phosphorylerede peptider med 95 % nøjagtighed og 91 % specificitet.
Metoden demonstreret i denne undersøgelse giver et uforudset perspektiv ind i verden af PTM'er i proteiner. Denne nye teknik vil også åbne op for nye veje for brugen af enkelt-molekyle detektion af PTM'er i klinisk diagnose og farmaceutiske applikationer.
"Der er en stærk sammenhæng mellem proteinphosphorylering og patogenesen af en lang række sygdomme. Vores metode vil gøre det muligt for forskere at finde ud af, hvordan fosforylering regulerer de cellulære begivenheder, der fører til en sygdoms oprindelse og derved hjælpe med udviklingen af behandlinger," siger han. afslutter Dr. Nishino. + Udforsk yderligere
Mod selvgendannende elektroniske enheder med lange DNA-molekyler
 Varme artikler
Varme artikler
-
 Indsigt i strukturelle materialers opførsel i et miljø med smeltet saltMia Maric (til venstre) og Dr. Ondrej Muransky. Kredit:Australian Nuclear Science and Technology Organisation (ANSTO) Et internationalt team af forskere ledet af ANSTO har fundet ud af, at koldval
Indsigt i strukturelle materialers opførsel i et miljø med smeltet saltMia Maric (til venstre) og Dr. Ondrej Muransky. Kredit:Australian Nuclear Science and Technology Organisation (ANSTO) Et internationalt team af forskere ledet af ANSTO har fundet ud af, at koldval -
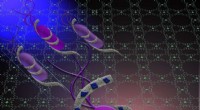 Bakterielle biofilm, forsvindEn kunstners repræsentation af bakterier (lilla) bliver kompromitteret af en organisk rammefilm i kitosan-metal. Kredit:Colorado State University/ Avancerede funktionelle materialer Efter nogle
Bakterielle biofilm, forsvindEn kunstners repræsentation af bakterier (lilla) bliver kompromitteret af en organisk rammefilm i kitosan-metal. Kredit:Colorado State University/ Avancerede funktionelle materialer Efter nogle -
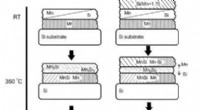 Fysikere overvåger dannelsen af film med højere mangansilicidSkematisk illustration af synteseproceduren til venstre:Mn17Si30 og højre Mn4Si7 -prøve. Kredit:Ivan Tarasov Et team fra Kirensky Institute of Physics (Siberian Branch of the Russian Academy of Sc
Fysikere overvåger dannelsen af film med højere mangansilicidSkematisk illustration af synteseproceduren til venstre:Mn17Si30 og højre Mn4Si7 -prøve. Kredit:Ivan Tarasov Et team fra Kirensky Institute of Physics (Siberian Branch of the Russian Academy of Sc -
 Brug af hvid eddike og isopropylalkoholHvid eddike eller eddikesyre og isopropylalkohol eller gnidning af alkohol er billig og praktisk til brug rundt omkring i huset. Begge kan bruges til rengøring, og de er også forholdsvis gode desinfek
Brug af hvid eddike og isopropylalkoholHvid eddike eller eddikesyre og isopropylalkohol eller gnidning af alkohol er billig og praktisk til brug rundt omkring i huset. Begge kan bruges til rengøring, og de er også forholdsvis gode desinfek
- Nyopdagede tvillingeplaneter kunne løse mysteriet med en puffy planet
- Lov om online sexhandel vil gøre tingene værre for ofrene, siger ekspert
- Selvmonterede nanotekstur skaber antireflekterende overflade på siliciumsolceller
- Sikre arbejdsprotokoller kan øge sandsynligheden for, at virksomheden fejler
- Lær af fotosyntese:Syntetiske kredsløb kan høste lysenergi
- Døden nær kystlinjen, ikke liv på land


