Hvordan kan vand være et neutralt molekyle, men stadig have positive og negative opladere på det?
1. Polaritet:
* vand er et polært molekyle. Dette betyder, at elektronerne i molekylet ikke deles lige mellem ilt- og hydrogenatomer. Oxygenatomet er mere elektronegativt (tiltrækker elektroner stærkere) end hydrogenatomerne.
* Som et resultat har iltatomet en lidt negativ ladning (Δ-), og hydrogenatomerne har lidt positive ladninger (Δ+). Denne ujævne fordeling af ladning skaber et dipolmoment i vandmolekylet.
2. Samlet neutralitet:
* Selvom iltatomet har en negativ ladning og brintatomerne har positive ladninger, er det samlede molekyle neutral. De positive og negative ladninger inden for molekylet annullerer hinanden.
3. Hydrogenbinding:
* De positive og negative ladninger på vandmolekyler giver dem mulighed for at danne hydrogenbindinger med hinanden. De lidt positive hydrogenatomer i et vandmolekyle tiltrækkes af det lidt negative iltatom i et andet vandmolekyle. Denne stærke attraktion er det, der giver vand mange af dets unikke egenskaber, som dets høje kogepunkt og evne til at opløse mange stoffer.
Kortfattet:
Vand er et polært molekyle med en lidt negativ ladning på iltatomet og lidt positive ladninger på brintatomerne. Molekylet som helhed er imidlertid neutral, fordi disse afgifter afbalancerer. Denne polaritet tillader vandmolekyler at danne hydrogenbindinger, som er vigtige for dets mange egenskaber.
Sidste artikelHvorfor er den samlede ladning på kerne positiv?
Næste artikelHvad har flere iltluftsække eller blod?
 Varme artikler
Varme artikler
-
 Nye biologiske og sikrere sæberKredit:CC0 Public Domain Et internationalt forskerhold ledet af professor Charles Gauthier fra Institut national de la recherche scientifique (INRS) har opdaget et nyt molekyle med potentiale til
Nye biologiske og sikrere sæberKredit:CC0 Public Domain Et internationalt forskerhold ledet af professor Charles Gauthier fra Institut national de la recherche scientifique (INRS) har opdaget et nyt molekyle med potentiale til -
 Sådan suger du kuldioxid fra himlen til brændstof og mereCarbon Engineerings rene brændstof, syntetiseret fra kuldioxid fanget fra luften og brint spaltet fra vand. Kredit:Carbon Engineering En skønne dag, den benzin, du køber, kan spore sin arv til kul
Sådan suger du kuldioxid fra himlen til brændstof og mereCarbon Engineerings rene brændstof, syntetiseret fra kuldioxid fanget fra luften og brint spaltet fra vand. Kredit:Carbon Engineering En skønne dag, den benzin, du køber, kan spore sin arv til kul -
 Ny undersøgelse analyserer levedygtigheden af bæredygtige brændstoffer udviklet gennem ny proce…En pilotreaktor, udviklet af Vertimass og placeret hos TechnipFMC, kan opskalere processen, der omdanner ethanol til brændstof, der er egnet til luftfart, forsendelse og andre tunge applikationer. Kre
Ny undersøgelse analyserer levedygtigheden af bæredygtige brændstoffer udviklet gennem ny proce…En pilotreaktor, udviklet af Vertimass og placeret hos TechnipFMC, kan opskalere processen, der omdanner ethanol til brændstof, der er egnet til luftfart, forsendelse og andre tunge applikationer. Kre -
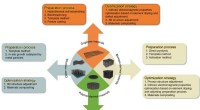 Seneste fremskridt inden for tredimensionelle porøse kulstofmaterialer til elektromagnetisk bølgea…Forskellige forberedelsesprocesser og optimeringsstrategier for 3D carbon EWAMer er opsummeret her. Kredit:Science China Press For nylig offentliggjorde professor Jiurong Liu og professor Zhihui Ze
Seneste fremskridt inden for tredimensionelle porøse kulstofmaterialer til elektromagnetisk bølgea…Forskellige forberedelsesprocesser og optimeringsstrategier for 3D carbon EWAMer er opsummeret her. Kredit:Science China Press For nylig offentliggjorde professor Jiurong Liu og professor Zhihui Ze
- Chainmail-katalysatorer:Carbon-indkapslede FeNi-legeringer til forbedret oxygenelektrokatalyse
- Forskere opdager, hvordan RNA poII opretholder nøjagtig transkription med supercomputer
- At finde orden og struktur i atomkaoset, hvor materialer mødes
- På Seychellerne, koralrev står over for klimaforandringer
- Argentinsk ubådsvrag fundet et år efter forsvinden
- Kan sociale medier registrere ændringerne i den offentlige stemning?


