Hvilket element vil have en ædelgaskonfiguration, hvis det danner en ionisk binding ved at acceptere et elektron fra natriumatom?
Her er hvorfor:
* natrium (NA) Har en valenselektron. Ved at miste denne elektron opnår det en stabil ædelgaskonfiguration som Neon (NE). Dette danner en positivt ladet natriumion (Na+).
* klor (Cl) Har syv valenselektroner. Ved at få en elektron opnår det også en stabil ædelgaskonfiguration som Argon (AR). Dette danner en negativt ladet chloridion (Cl-).
Den elektrostatiske tiltrækning mellem den positivt ladede natriumion og det negativt ladede chloridion danner den ioniske binding, hvilket resulterer i dannelse af natriumchlorid (NaCl), også kendt som tabel salt.
Sidste artikelHvad i modsætning til metaller er mange ikke -metaller?
Næste artikelEr folinsyrefedtopløselig vandopløselig?
 Varme artikler
Varme artikler
-
 En mulig afslutning på evige kemikalierKredit:Marla Bereni/UCR Syntetiske kemikalier kendt som per- og polyfluoralkyler, eller PFAS, indeholder bindinger mellem kulstof- og fluoratomer, der anses for at være de stærkeste i organisk kem
En mulig afslutning på evige kemikalierKredit:Marla Bereni/UCR Syntetiske kemikalier kendt som per- og polyfluoralkyler, eller PFAS, indeholder bindinger mellem kulstof- og fluoratomer, der anses for at være de stærkeste i organisk kem -
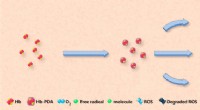 Fremstilling af kunstigt blod til transfusionerKredit:American Chemical Society Blodtransfusioner kan redde livet for patienter, der har lidt stort blodtab, men hospitaler har ikke altid nok eller den rigtige type ved hånden. På jagt efter en
Fremstilling af kunstigt blod til transfusionerKredit:American Chemical Society Blodtransfusioner kan redde livet for patienter, der har lidt stort blodtab, men hospitaler har ikke altid nok eller den rigtige type ved hånden. På jagt efter en -
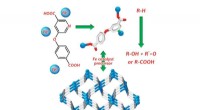 Kemiker syntetiserer jernkoordinationspolymer med nikotinsyrederivatKredit:RUDN Universitet RUDN kemiker syntetiseret jern (II) 3-D koordinationspolymer, den første koordinationsforbindelse af jern, sammensat af substitueret nikotinsyre H2cpna. Denne forbindelse k
Kemiker syntetiserer jernkoordinationspolymer med nikotinsyrederivatKredit:RUDN Universitet RUDN kemiker syntetiseret jern (II) 3-D koordinationspolymer, den første koordinationsforbindelse af jern, sammensat af substitueret nikotinsyre H2cpna. Denne forbindelse k -
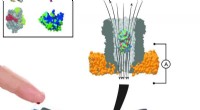 Ny metode måler enkelte molekyler fra nanoliter blod i realtidEn nanopore-enhed kan indeholde forskellige bindingsproteiner. En gang inde i poren, disse proteiner fungerer som transducere til at identificere specifikke små molekyler i en prøve af kropsvæske. Kre
Ny metode måler enkelte molekyler fra nanoliter blod i realtidEn nanopore-enhed kan indeholde forskellige bindingsproteiner. En gang inde i poren, disse proteiner fungerer som transducere til at identificere specifikke små molekyler i en prøve af kropsvæske. Kre
- Urban, hjemmehaver kunne hjælpe med at bremse fødevareusikkerhed, sundhedsproblemer
- Hvad sker der, hvis en person har flere eller mindre kromosomer?
- Hvilken slags havstrømme kan forårsage spredning af havbunden?
- Hvorfor er cinder -kegler kortvarige?
- Hvad kunne der gøres for at øge nedbrydningshastigheden caco3?
- Hvad er egenskaberne ved en ø?


