Hvad er de bedste betingelser for at opløse en gas i væske?
1. Højt tryk:
* Forklaring: Stigende tryk tvinger gasmolekyler tættere sammen, hvilket øger deres chancer for at kollidere med væskens overflade og opløste. Dette er beskrevet af Henrys lov, der siger, at opløseligheden af en gas i en væske er direkte proportional med det delvise tryk på gassen over væsken.
* Eksempel: Kuldioxid er mere opløseligt i soda under højt tryk, og det er grunden til, at soda går fladt, når det åbnes (tryk falder).
2. Lav temperatur:
* Forklaring: Sænkning af temperaturen reducerer den kinetiske energi i gasmolekyler, hvilket gør dem mindre tilbøjelige til at flygte fra væsken tilbage i gasfasen.
* Eksempel: Du kan opløse mere ilt i koldt vand end i varmt vand, hvorfor koldt vand understøtter mere akvatisk liv.
3. Høj polaritet af væsken:
* Forklaring: Gasser opløses bedre i væsker, der har lignende polariteter. Polære væsker (som vand) har en tendens til at opløse polære gasser (som ammoniak). Ikke -polære væsker (som olie) har en tendens til at opløse ikke -polære gasser (som metan).
* Eksempel: Kuldioxid, en let polær gas, er mere opløselig i vand (polær) end i olie (ikke -polær).
4. Omrøring eller agitation:
* Forklaring: Agitation hjælper med at øge overfladearealet mellem gas og væske, lette flere kollisioner og opløse.
* Eksempel: At ryste en flaske soda hjælper med at opløse mere kuldioxid.
5. Gasens lav molekylvægt:
* Forklaring: Gasser med lavere molekylvægte har en tendens til at være mere opløselige i væsker. Dette skyldes, at de har mindre intermolekylær tiltrækning mellem deres molekyler, hvilket gør det lettere for dem at flygte fra gasfasen.
* Eksempel: Helium, en meget let gas, er mindre opløselig i vand end ilt, en tungere gas.
6. Specifikke gas-væske-interaktioner:
* Forklaring: Nogle gas-væskepar har unikke interaktioner, der kan påvirke opløselighed. For eksempel kan nogle gasser danne svage bindinger med flydende molekyler, hvilket gør dem mere opløselige.
* Eksempel: Kuldioxid danner kulsyre (H2CO3) i vand, hvilket øger dens opløselighed.
Vigtig note: Disse faktorer interagerer med hinanden, og deres kombinerede virkning bestemmer den samlede opløselighed af en gas i en væske.
Sidste artikelHvad er størrelse på DMSO -molekyle?
Næste artikelHvilket stof fysiske egenskaber afhænger af sammensætningen?
 Varme artikler
Varme artikler
-
 Pig-Pen-effekt:Blanding af hudolie og ozon kan producere en personlig forureningsskyNår ozon rammer olier på huden og i snavset tøj, det kan producere en personlig sky af irriterende stoffer. Kredit:Penn State Når ozon og hudolier mødes, den resulterende reaktion kan hjælpe med a
Pig-Pen-effekt:Blanding af hudolie og ozon kan producere en personlig forureningsskyNår ozon rammer olier på huden og i snavset tøj, det kan producere en personlig sky af irriterende stoffer. Kredit:Penn State Når ozon og hudolier mødes, den resulterende reaktion kan hjælpe med a -
 Katalytiske protoceller bliver nervøseMørkefeltmikroskopibillede af en enkelt multi-kompartmental kapsel indeholdende tusindvis af katalytiske protoceller, der nedbryder hydrogenperoxid til vand og oxygengas. Kredit:Dr. Pierangelo Gobbo o
Katalytiske protoceller bliver nervøseMørkefeltmikroskopibillede af en enkelt multi-kompartmental kapsel indeholdende tusindvis af katalytiske protoceller, der nedbryder hydrogenperoxid til vand og oxygengas. Kredit:Dr. Pierangelo Gobbo o -
 Nye syrefaste membraner til spildevandsrensning udvikletSkematisk mekanisme til fremstilling af syrefast nanofiltreringsmembran og dens overlegne separationsydelse. Kredit:CAO Yang En forskergruppe ledet af prof. Wan Yinhua fra Institute of Process Eng
Nye syrefaste membraner til spildevandsrensning udvikletSkematisk mekanisme til fremstilling af syrefast nanofiltreringsmembran og dens overlegne separationsydelse. Kredit:CAO Yang En forskergruppe ledet af prof. Wan Yinhua fra Institute of Process Eng -
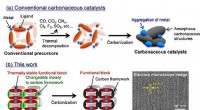 En ny synteserute for alternative katalysatorer af ædelmetallerSynteseskemaer af (a) konventionelle carbonholdige katalysatorer og (b) dette arbejde for ordnede carbonholdige rammer. Kredit:Hirotomo Nishihara Forskere har udviklet en ny synteserute for altern
En ny synteserute for alternative katalysatorer af ædelmetallerSynteseskemaer af (a) konventionelle carbonholdige katalysatorer og (b) dette arbejde for ordnede carbonholdige rammer. Kredit:Hirotomo Nishihara Forskere har udviklet en ny synteserute for altern
- Hvad er eksemplerne på enzymkatalysatorer?
- At spise meget kød er dårligt for miljøet, men vi ved ikke nok om, hvordan forbruget ændrer sig
- Boeing insisterer på, at de vil dele oplysninger med kunder efter nedbrud i Indonesien
- Kan du være afhængig af endorfiner?
- Er det sandt nitrogengas er nødvendig for at hjælpe med at beskytte levende ting mod skadelig strå…
- At spise lokal og plantebaseret kost:hvordan man fodrer byer bæredygtigt


