Hvad er egenskaberne ved reaktivitet?
Faktorer, der påvirker reaktivitet:
* Elektronegativitet: Dette henviser til en atoms tendens til at tiltrække elektroner. Meget elektronegative atomer er mere tilbøjelige til at danne bindinger og reagere med andre atomer.
* ioniseringsenergi: Dette er den energi, der kræves for at fjerne et elektron fra et atom. Elementer med lav ioniseringsenergi er mere tilbøjelige til at miste elektroner og deltage i reaktioner.
* Elektronaffinitet: Dette er energiændringen, når et elektron tilsættes til et neutralt atom. Elementer med høj elektronaffinitet accepterer let elektroner, hvilket øger reaktiviteten.
* obligationsstyrke: Stærke bindinger kræver mere energi til at bryde, hvilket gør molekylet mindre reaktivt. Omvendt brydes svage bindinger lettere, hvilket fører til højere reaktivitet.
* tilstedeværelse af funktionelle grupper: Visse funktionelle grupper (som hydroxyl-, carboxyl- eller aminogrupper) gør molekyler mere reaktive på grund af deres evne til at danne bindinger med andre molekyler.
* overfladeareal: Forøget overfladeareal giver mulighed for flere kontaktpunkter for reaktioner, hvilket fører til øget reaktivitet.
* Temperatur: Højere temperaturer øger generelt reaktionshastigheden, da molekyler har mere kinetisk energi og er mere tilbøjelige til at kollidere og reagere.
* tilstedeværelse af katalysatorer: Katalysatorer fremskynder reaktioner uden at blive fortæret sig selv, hvilket gør dem mere tilbøjelige til at forekomme.
* Fysisk tilstand: Gasser har en tendens til at være mere reaktive end væsker eller faste stoffer, fordi deres molekyler er mere spredte og har flere kollisioner.
Eksempler:
* Metaller: Alkalimetaller (som lithium, natrium, kalium) er meget reaktive på grund af deres lave ioniseringsenergi. De mister let elektroner for at danne positive ioner.
* ikke -metaller: Halogener (som fluor, klor, brom) er meget reaktive på grund af deres høje elektronegativitet og stærk tendens til at få elektroner.
* organiske forbindelser: Hydrocarbons with multiple double or triple bonds are more reactive due to the presence of electron-rich pi bonds.
Det er vigtigt at huske det:
* reaktivitet er relativ: Et stof, der er meget reaktivt i et scenarie, kan være ureaktivt i et andet.
* reaktivitet kan ændre sig: Faktorer som temperatur, tryk og tilstedeværelsen af katalysatorer kan ændre et stofs reaktivitet.
Derfor snarere end specifikke "egenskaber", tænk på reaktivitet som et komplekst samspil af faktorer, der bestemmer, hvor let et stof deltager i kemiske reaktioner.
Sidste artikelHvor mange mol CC14 er til stede i 56G?
Næste artikelHvad er det kogende og smeltepunkt for helium i Fahrenheit?
 Varme artikler
Varme artikler
-
 Energieffektiv grøn vej til magnesiumproduktion(Venstre) Faktisk pellet af dolomit og ferrosilicium. Den hvide del er rig på dolomit, og den sorte del er rig på ferrosilicium. Ferrosilicium er koncentreret i den midterste del. (Højre) Fem stablet
Energieffektiv grøn vej til magnesiumproduktion(Venstre) Faktisk pellet af dolomit og ferrosilicium. Den hvide del er rig på dolomit, og den sorte del er rig på ferrosilicium. Ferrosilicium er koncentreret i den midterste del. (Højre) Fem stablet -
 Forskere skaber en krystal i en krystal til nye elektroniske enhederForskere ved Pritzker School for Molecular Engineering ved University of Chicago annoncerer et gennembrud med blå flydende fasekrystaller, som skaber disse smukke mønstre set under et mikroskop. Kredi
Forskere skaber en krystal i en krystal til nye elektroniske enhederForskere ved Pritzker School for Molecular Engineering ved University of Chicago annoncerer et gennembrud med blå flydende fasekrystaller, som skaber disse smukke mønstre set under et mikroskop. Kredi -
 Supercomputing mere lys end varmeMaverick-supercomputersystemet ved Texas Advanced Computing Center. Maverick er en XSEDE-allokeret dedikeret visualiserings- og dataanalyseressource bygget med 132 NVIDIA Tesla K40 Atlas GPU til fjern
Supercomputing mere lys end varmeMaverick-supercomputersystemet ved Texas Advanced Computing Center. Maverick er en XSEDE-allokeret dedikeret visualiserings- og dataanalyseressource bygget med 132 NVIDIA Tesla K40 Atlas GPU til fjern -
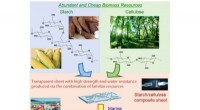 Forskere skaber vandnedbrydelig plast, der kombinerer stivelse og celluloseFig. 1. Marine bionedbrydeligt plastpræparat fra stivelse og cellulose. Kredit:Osaka University Hovedårsagen til akkumulering af havaffald er dumpning af plastikaffald i havene, da det meste plast
Forskere skaber vandnedbrydelig plast, der kombinerer stivelse og celluloseFig. 1. Marine bionedbrydeligt plastpræparat fra stivelse og cellulose. Kredit:Osaka University Hovedårsagen til akkumulering af havaffald er dumpning af plastikaffald i havene, da det meste plast
- Er det sandt eller falsk studiet af stof, og hvordan ændringer kaldes fysiske?
- Hvordan maskinlæring kan hjælpe regulatorer
- Forskere afslører, hvordan acetylering regulerer centromerdynamik, kromosomadskillelse og mitotisk …
- Hvordan påvirker lyden hjertefrekvensen?
- Apple lancerer iOS 13 offentlig beta:10 grunde til at få softwaren nu, hvis du føler dig modig
- Børn, der har eftermiddagsskolepauser, er mere raske, men har brug for et støttende miljø


