Hvad er den teoretiske procentdel zink i en prøve af iodid?
* iodid er et generisk udtryk: Det henviser til anion I⁻. Der er mange forskellige forbindelser, der indeholder iodid. For eksempel:
* zinkiodid (Zni₂) :Dette er en forbindelse, der indeholder både zink og iodid.
* kaliumiodid (KI) :Denne forbindelse indeholder ikke zink.
* procent sammensætning afhænger af den specifikke forbindelse: Procentdelen af zink i en forbindelse bestemmes af forholdet mellem zinkmassen og den samlede masse af forbindelsen.
For at bestemme den teoretiske procentdel zink skal du kende den specifikke forbindelse, du har at gøre med.
Her er hvordan man beregner den procentvise zink i en forbindelse:
1. Find den molære masse af forbindelsen.
2. Find den molære masse af zink.
3.
`` `
Procent zink =(molmasse zink / molmasse af forbindelse) * 100%
`` `
Eksempel:
Lad os sige, at du vil finde den procentvise zink i zinkiodid (Zni₂):
1. molmasse Zni₂: 65,38 g/mol (Zn) + 2 * 126,90 g/mol (i) =319,18 g/mol
2. molmasse Zn: 65,38 g/mol
3. procent zink: (65,38 g/mol/319,18 g/mol) * 100% =20,48%
Derfor er den teoretiske procentdel zink i zinkiodid 20,48%.
 Varme artikler
Varme artikler
-
 Ingeniører kan opdage ultra sjældne proteiner i blodet ved hjælp af et mobiltelefonkameraForskernes detektionssystem bruger et standard mobiltelefonkamera til at optage video af mikrodråber, når de passerer linsen. Fluorescerende markører kan identificeres individuelt ved at matche dem me
Ingeniører kan opdage ultra sjældne proteiner i blodet ved hjælp af et mobiltelefonkameraForskernes detektionssystem bruger et standard mobiltelefonkamera til at optage video af mikrodråber, når de passerer linsen. Fluorescerende markører kan identificeres individuelt ved at matche dem me -
 Sådan forbliver muslinger isfri i en iskold verdenPå grund af en regelmæssig overfladestruktur på muslingen Adamussium colbecki klæber isen kun meget svagt til den og kan let skylles væk af strøm. Kredit:Max Planck Institute for Polymer Research A
Sådan forbliver muslinger isfri i en iskold verdenPå grund af en regelmæssig overfladestruktur på muslingen Adamussium colbecki klæber isen kun meget svagt til den og kan let skylles væk af strøm. Kredit:Max Planck Institute for Polymer Research A -
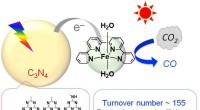 Reduktion af CO2 med fælles elementer og sollysCO 2 reduktion ved anvendelse af en fotokatalysator, der kombinerer carbonnitrid og et jernkompl. Kredit:Osamu Ishitani En international forskningsgruppe, der samarbejder med Tokyo Institute of
Reduktion af CO2 med fælles elementer og sollysCO 2 reduktion ved anvendelse af en fotokatalysator, der kombinerer carbonnitrid og et jernkompl. Kredit:Osamu Ishitani En international forskningsgruppe, der samarbejder med Tokyo Institute of -
 Skjulte forvrængninger udløser lovende termoelektrisk egenskabBrookhaven Lab-medlemmer af forskerholdet:Simon Billinge, Milinda Abeykoon og Emil Bozin justerer instrumenter til dataindsamling ved parfordelingsfunktionens beamline af National Synchrotron Light So
Skjulte forvrængninger udløser lovende termoelektrisk egenskabBrookhaven Lab-medlemmer af forskerholdet:Simon Billinge, Milinda Abeykoon og Emil Bozin justerer instrumenter til dataindsamling ved parfordelingsfunktionens beamline af National Synchrotron Light So


