Hvordan påvirker salt det smelte og frysepunkt for vand?
Sænkning af frysepunktet (frysningspunktdepression):
* Forstyrrelse af vandstruktur: Når salt (NaCl) opløses i vand, bryder det ned i natrium (Na+) og chlorid (Cl-) ioner. Disse ioner forstyrrer den normale hydrogenbinding mellem vandmolekyler. Vandmolekyler danner normalt en struktureret, krystallinsk gitter ved frysning. Ionerne forstyrrer denne dannelse, hvilket gør det sværere for vandet at størkne.
* mere energi nødvendigt: Som et resultat skal vandet være koldere end 0 ° C (32 ° F) for at fryse. Denne forskel i temperatur kaldes frysepunktdepression.
* Beløbet betyder noget: Jo mere salt du opløser, jo større er frysepunktdepressionen.
hæver smeltepunktet (kogepunkthøjde):
* Lignende mekanisme: Det samme princip, der sænker frysepunktet, gælder også kogepunktet. De opløste ioner forstyrrer vandstrukturen og gør det sværere for vandmolekylerne at flygte ind i dampfasen.
* Højere temperatur nødvendig: Som et resultat skal vandet være varmere end 100 ° C (212 ° F) for at koge.
Hvorfor er dette vigtigt?
* Vejafisning: Salt bruges til at smelte is og sne på veje om vinteren, fordi det sænker det frysepunkt for vand. Dette forhindrer dannelsen af et solidt islag, hvilket gør veje mere sikker til kørsel.
* Fødevarekonservering: Salt bruges til at bevare mad, fordi det sænker frysen af vandet inde i maden, hvilket gør det sværere for bakterier at vokse.
* Andre applikationer: Frysepunktdepression og kogepunkthøjde har applikationer på mange andre områder, herunder:
* frostvæske til motorer: Lovfrustrion indeholder forbindelser, der sænker frysepunktet for kølevæsken, hvilket forhindrer det i at fryse i koldt vejr.
* saltvandsløsninger: Saltwater har et lavere frysepunkt og et højere kogepunkt end ferskvand, og det er grunden til, at oceanerne ikke fryser fast om vinteren.
Fortæl mig, hvis du har andre spørgsmål om salt og dens virkninger på vand!
 Varme artikler
Varme artikler
-
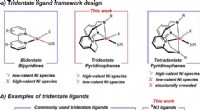 Nyt molekyle sætter scenen for nikkel som en grønnere fotokatalysator, afslører vigtige trin i re…et Tridentate ligandrammedesign. b Repræsentative tridentate N-donorligander, der almindeligvis anvendes til at stabilisere ualmindelige Ni-oxidationstilstande og RN3 tridentate ligander udviklet i de
Nyt molekyle sætter scenen for nikkel som en grønnere fotokatalysator, afslører vigtige trin i re…et Tridentate ligandrammedesign. b Repræsentative tridentate N-donorligander, der almindeligvis anvendes til at stabilisere ualmindelige Ni-oxidationstilstande og RN3 tridentate ligander udviklet i de -
 Forskere udvikler nanoporøs super-multi-element katalysatorKredit:Japan Science and Technology Agency (JST) En fælles forskergruppe ledet af forskningsassistent Cai ZeXing og professor Takeshi Fujita ved School of Environmental Science and Engineering, Ko
Forskere udvikler nanoporøs super-multi-element katalysatorKredit:Japan Science and Technology Agency (JST) En fælles forskergruppe ledet af forskningsassistent Cai ZeXing og professor Takeshi Fujita ved School of Environmental Science and Engineering, Ko -
 At lave tøj af mælkKredit:Piotr Łohunko I EU, beboere spilder anslået 88 millioner tons mad hvert år, ifølge de seneste skøn. Det er omkring 170 kg pr. person. Men hvad nu hvis videnskabsmænd kunne omdanne noget af
At lave tøj af mælkKredit:Piotr Łohunko I EU, beboere spilder anslået 88 millioner tons mad hvert år, ifølge de seneste skøn. Det er omkring 170 kg pr. person. Men hvad nu hvis videnskabsmænd kunne omdanne noget af -
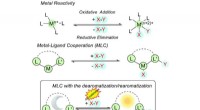 Forståelse af aromaticitet i katalyse for at låse op for nye mulighederFig. 1 Forskellige former for substrataktivering i konventionel og metal-ligand kooperativ katalyse. Kredit: Kemisk kommunikation (2021). DOI:10.1039/D1CC00528F Aromaticitet, et koncept, der norm
Forståelse af aromaticitet i katalyse for at låse op for nye mulighederFig. 1 Forskellige former for substrataktivering i konventionel og metal-ligand kooperativ katalyse. Kredit: Kemisk kommunikation (2021). DOI:10.1039/D1CC00528F Aromaticitet, et koncept, der norm
- Sådan polskes klipper og perler uden en klippetrommel
- Hvordan en partikel kan stå stille i roterende rumtid
- En ny tilgang til at beregne jordskælvsskridningsfordelinger
- Tredimensionel selvsamling ved hjælp af dipolær interaktion
- Ny undersøgelse kaster lys over den mystiske dæmpning af Betelgeuse
- Science Fair Ideer, der vil hjælpe Society


