Hvor mange valenselektroner alkalimetaller har?
Her er hvorfor:
* Valenselektroner: Dette er elektronerne i den yderste skal af et atom, og det er dem, der er involveret i kemisk binding.
* alkalimetaller: Dette er elementerne i gruppe 1 i den periodiske tabel (Li, Na, K, RB, CS, FR).
* Elektronkonfiguration: Alkalimetaller har et elektron i deres yderste s orbital. For eksempel har natrium (NA) elektronkonfigurationen 1S² 2S²2P⁶3S¹, hvor 3S¹ -elektronet er valenselektronen.
Denne enkelt valenselektron er grunden til, at alkalimetaller er meget reaktive. De mister let dette elektron til dannelse af en +1 -kation, hvorfor de altid findes i ioniske forbindelser.
 Varme artikler
Varme artikler
-
 Undersøgelse af atomstruktur af aluminiumslegeringer til fremstilling af moderne flyKredit:Pixabay/CC0 Public Domain Forskere fra Belgorod State University (BSU) og Skolkovo Institute of Science and Technology (Skoltech) studerede aluminiumslegeringer på atomniveau og fandt mønstr
Undersøgelse af atomstruktur af aluminiumslegeringer til fremstilling af moderne flyKredit:Pixabay/CC0 Public Domain Forskere fra Belgorod State University (BSU) og Skolkovo Institute of Science and Technology (Skoltech) studerede aluminiumslegeringer på atomniveau og fandt mønstr -
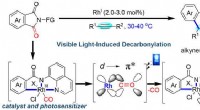 Synligt lys-induceret bifunktionel rhodiumkatalyse udviklet til decarbonylativ kobling af imider med…Lysinduceret bifunktionel rhodiumkatalyse til decarbonylering. Kredit:MIN Xiangting Carbonylgrupper er allestedsnærværende i lægemidler, naturlige produkter, og landbrugskemikalier, især amider. O
Synligt lys-induceret bifunktionel rhodiumkatalyse udviklet til decarbonylativ kobling af imider med…Lysinduceret bifunktionel rhodiumkatalyse til decarbonylering. Kredit:MIN Xiangting Carbonylgrupper er allestedsnærværende i lægemidler, naturlige produkter, og landbrugskemikalier, især amider. O -
 UCI-forskere er de første til at observere, billede altafgørende molekylære vibrationerVi har et mikroskop nu, der kan opløse atomer, og vi bruger det til at se ind i molekyler, hvilket var utænkeligt for kun få år siden, siger studiemedforfatter V. Ara Apkarian (til højre), direktør fo
UCI-forskere er de første til at observere, billede altafgørende molekylære vibrationerVi har et mikroskop nu, der kan opløse atomer, og vi bruger det til at se ind i molekyler, hvilket var utænkeligt for kun få år siden, siger studiemedforfatter V. Ara Apkarian (til højre), direktør fo -
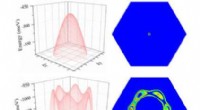 Kunne et nyt 2-D-materiale tillade, at halvledere bliver ved med at blive mindre, stærkere bedre og…I modsætning til andre materialer med elektroner, der spredes i mange retninger (nederst til venstre), elektronerne i 2D -antimon (øverst til venstre) kan fås til at bevæge sig sammen på en ordnet måd
Kunne et nyt 2-D-materiale tillade, at halvledere bliver ved med at blive mindre, stærkere bedre og…I modsætning til andre materialer med elektroner, der spredes i mange retninger (nederst til venstre), elektronerne i 2D -antimon (øverst til venstre) kan fås til at bevæge sig sammen på en ordnet måd
- Hvad er lipiderne polymerer?
- Genbrugseksperter har nået milepæl i jagten på en telefon uden affald
- Nye værktøjer kan give jernbeklædt vished om, at computerfejl hører fortiden til
- $70.000 til Zoom-undervisning? Viruskrise efterlader amerikanske studerende kede af det
- Ved hjælp af supercomputere til at fordybe sig i materiens byggesten
- Hvor mange mmol svarer til 52 meq kalium?


