Hvordan adskiller alkalimetaller sig fra alkaliske metaller?
alkalimetaller og alkaliske jordmetaller er to forskellige grupper på den periodiske tabel. Her er sammenbruddet:
* alkalimetaller er i gruppe 1 (IA) af den periodiske tabel. De er meget reaktive metaller med en valenselektron. Eksempler inkluderer lithium (Li), natrium (NA), kalium (K), rubidium (RB), cesium (CS) og Francium (FR).
* alkaliske jordmetaller er i gruppe 2 (IIA) af den periodiske tabel. De er også reaktive metaller, men mindre reaktive end alkalimetaller. De har to valenselektroner. Eksempler inkluderer beryllium (BE), magnesium (Mg), calcium (CA), strontium (SR), barium (BA) og radium (RA).
Nøgleforskelle:
* Antal valenselektroner: Alkalimetaller har en valenselektron, mens alkaliske jordmetaller har to.
* reaktivitet: Alkalimetaller er mere reaktive end alkaliske jordmetaller på grund af deres enkelt valenselektron, som let går tabt.
* Fysiske egenskaber: Alkalimetaller er blødere og har lavere smelte- og kogepunkter end alkaliske jordmetaller.
* Kemiske egenskaber: Alkalimetaller reagerer let med vand for at danne hydroxider og brintgas, mens alkaliske jordmetaller reagerer langsommere.
Sammenfattende er "alkaliske metaller" ikke et gyldigt udtryk. De korrekte udtryk er alkalimetaller og alkaliske jordmetaller, som er to forskellige grupper på den periodiske tabel med forskellige egenskaber.
Sidste artikelHvordan er alkaliske metaller sammenlignet med alkalimetaller?
Næste artikelHvor mange valenselektroner alkalimetaller har?
 Varme artikler
Varme artikler
-
 Forebyggelse af infektion, lette helbredelse:Nye biomaterialer fra edderkoppesilkeScanning af elektronmikroskopbilleder giver et overvældende bevis på forskellen. Til venstre:En biofilm dannes på overfladen af polycaprolacton, en bionedbrydelig plast, der ofte bruges i medicin. T
Forebyggelse af infektion, lette helbredelse:Nye biomaterialer fra edderkoppesilkeScanning af elektronmikroskopbilleder giver et overvældende bevis på forskellen. Til venstre:En biofilm dannes på overfladen af polycaprolacton, en bionedbrydelig plast, der ofte bruges i medicin. T -
 Brintlagringsreaktioner bærer en kompleks dans mod hurtigere optagelseHydrogenabsorption ved overfladen af magnesiumdiborid studeret med simuleringer af første principper. Kredit:ACS Applied Materials &Interfaces (2022). DOI:10.1021/acsami.1c23524 Lawrence Livermor
Brintlagringsreaktioner bærer en kompleks dans mod hurtigere optagelseHydrogenabsorption ved overfladen af magnesiumdiborid studeret med simuleringer af første principper. Kredit:ACS Applied Materials &Interfaces (2022). DOI:10.1021/acsami.1c23524 Lawrence Livermor -
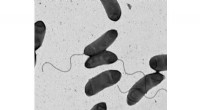 En usædvanlig form for antibiotikaresistens ved pandemisk koleraBilledet er et elektronmikrografi af bakterien Vibrio kolerae , det forårsagende middel til koleraen. Kredit:M. Stephen Trent, University of Georgia Kolera er en ødelæggende sygdom for millioner
En usædvanlig form for antibiotikaresistens ved pandemisk koleraBilledet er et elektronmikrografi af bakterien Vibrio kolerae , det forårsagende middel til koleraen. Kredit:M. Stephen Trent, University of Georgia Kolera er en ødelæggende sygdom for millioner -
 Forskere skaber ingredienser til at producere mad ved hjælp af 3D-printFødevareingeniører i Brasilien og Frankrig udviklede geler baseret på modificeret stivelse til brug som blæk til fremstilling af fødevarer og nye materialer ved additiv fremstilling. Kredit:Bianca C.
Forskere skaber ingredienser til at producere mad ved hjælp af 3D-printFødevareingeniører i Brasilien og Frankrig udviklede geler baseret på modificeret stivelse til brug som blæk til fremstilling af fødevarer og nye materialer ved additiv fremstilling. Kredit:Bianca C.
- Erstatning for PFAS fundet i jord i New Jersey
- Tager dyr det meste af ilt?
- Østlige EU-stater modsatte sig 2050-målet om nulemissioner
- Bevis på bredsidekollision med dværggalakse opdaget i Mælkevejen
- Hvad sker der, når vi tildeler menneskelige egenskaber til virksomheder?
- Nanoteknologi gør det muligt for forskere at fange og bevare kræftceller, der cirkulerer i blodban…


