Hvordan er PH -skalaen opsat?
1. Sortimentet:
* PH -skalaen varierer fra 0 til 14.
* En pH på 7 er neutral , hvilket betyder, at opløsningen hverken er sur eller alkalisk.
* Løsninger med pH under 7 er sure , med lavere antal, der indikerer stærkere surhed.
* Løsninger med pH over 7 er alkaliske (basale) med højere antal, der indikerer stærkere alkalinitet.
2. Den logaritmiske natur:
* PH -skalaen er logaritmisk, hvilket betyder, at hver hele antal ændringer i pH repræsenterer en ti gange ændring i hydrogenionkoncentration ([H+]).
* For eksempel har en opløsning med en pH på 5 ti gange hydrogenionkoncentrationen af en opløsning med en pH på 6.
3. Formlen:
* PH i en opløsning beregnes ved hjælp af følgende formel:
ph =-log [H+]
Hvor:
* pH er pH i opløsningen
* [H+] er hydrogenionkoncentrationen i mol pr. Liter (mol/L).
Kortfattet:
* PH -skalaen er en bekvem måde at udtrykke surhedsgraden eller alkaliniteten af en opløsning.
* En lavere pH indikerer højere surhedsgrad, en højere pH indikerer højere alkalinitet, og en pH -værdi på 7 er neutral.
* Skalaen er logaritmisk, så en ændring af en pH -enhed repræsenterer en ti gange ændring i hydrogenionkoncentration.
Eksempel:
* En opløsning med en pH på 3 er 100 gange mere sur end en opløsning med en pH på 5.
* pH 3:[H+] =10^-3 mol/l
* pH 5:[H+] =10^-5 mol/l
 Varme artikler
Varme artikler
-
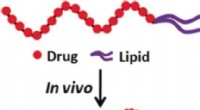 Transport af lipidkonjugeret floxuridin med naturligt serumalbumin til levering til kræftcellerKredit:Wiley Hvordan kan eliminering af terapeutiske midler fra blodbanen eller deres tidlige enzymatiske nedbrydning undgås ved systemisk levering? Kinesiske forskere har nyudviklet en metode til
Transport af lipidkonjugeret floxuridin med naturligt serumalbumin til levering til kræftcellerKredit:Wiley Hvordan kan eliminering af terapeutiske midler fra blodbanen eller deres tidlige enzymatiske nedbrydning undgås ved systemisk levering? Kinesiske forskere har nyudviklet en metode til -
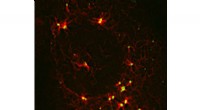 Kaster lys på en skyggefuld organisatorisk hub i cellerEt stort protein koordinerer cellulære komponenter, der kræves til mikrotubulussamling. Kredit:James Goldenring, Vanderbilt Universitet På cellulært niveau, vi hænger alle sammen med sarte tråde.
Kaster lys på en skyggefuld organisatorisk hub i cellerEt stort protein koordinerer cellulære komponenter, der kræves til mikrotubulussamling. Kredit:James Goldenring, Vanderbilt Universitet På cellulært niveau, vi hænger alle sammen med sarte tråde. -
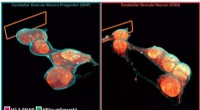 Mikroskopiteknik afslører cellers 3-D ultrastruktur i nye detaljerInde i en celle, tentakler vesikler shuttle last til sortering. DNA omarrangeres i kernen, efterhånden som stamceller differentieres til neuroner. Naboneuroner klamrer sig til hinanden gennem en web-l
Mikroskopiteknik afslører cellers 3-D ultrastruktur i nye detaljerInde i en celle, tentakler vesikler shuttle last til sortering. DNA omarrangeres i kernen, efterhånden som stamceller differentieres til neuroner. Naboneuroner klamrer sig til hinanden gennem en web-l -
 Bionedbrydelige plantebeskyttelsesmidler uden risici eller bivirkningerEt hold fra det tekniske universitet i München (TUM) har udviklet et biologisk nedbrydeligt middel, der holder skadedyr på afstand uden at forgifte dem:som myggemiddel, der bruges af badende om sommer
Bionedbrydelige plantebeskyttelsesmidler uden risici eller bivirkningerEt hold fra det tekniske universitet i München (TUM) har udviklet et biologisk nedbrydeligt middel, der holder skadedyr på afstand uden at forgifte dem:som myggemiddel, der bruges af badende om sommer
- Den videnskabelige formel beregner, hvordan man kan skabe mere plads til fodgængere i post-pandemis…
- Syv tips til at få masker til at fungere i klasseværelset
- Hvad er navnene på 29 månefaser?
- Tyske fiskeres skepsis over for EU hindrer overholdelsen af dets regler
- Hvilke løsninger gør sølvklorid?
- Hvordan når energien fra et jordskælv overflade jord?


