Hvad er der i et molekyle påvirker den måde, der reagerer på?
1. Molekylær struktur og binding:
* Funktionelle grupper: Specifikke grupper af atomer inden for et molekyle (som hydroxyl-, carbonyl- eller amingrupper) giver tydelig reaktivitet. For eksempel er en carbonylgruppe tilbøjelig til nukleofil angreb, mens en hydroxylgruppe kan fungere som en nukleofil eller en forladt gruppe.
* obligationsstyrker og polaritet: Stærke bindinger kræver mere energi til at bryde, hvilket gør molekyler mindre reaktive. Polære bindinger, hvor elektroner er ulige deles, kan skabe regioner med delvis positiv og negativ ladning, hvilket påvirker, hvordan et molekyle interagerer med andre molekyler.
* molekylær geometri: Formen på et molekyle bestemmer, hvordan det kan interagere med andre molekyler. For eksempel kan et lineært molekyle være mindre reaktivt end et forgrenet molekyle.
2. Elektroniske egenskaber:
* Elektrondensitet: Regioner med høj elektrondensitet er mere tilbøjelige til at tiltrække elektrofiler (elektronelskende arter), mens regioner med lav elektrondensitet er mere tilbøjelige til at tiltrække nukleofiler (elektronrige arter).
* orbital overlapning: Omfanget af overlapning mellem orbitaler af forskellige atomer påvirker styrken og typen af dannet kemisk binding, der direkte påvirker reaktiviteten.
3. Miljøfaktorer:
* Temperatur: Højere temperaturer giver mere energi til at overvinde aktiveringsenergier, hvilket øger reaktionshastigheden.
* opløsningsmiddel: Polariteten og egenskaberne af opløsningsmidlet kan påvirke hastigheden og typen af reaktion ved at stabilisere eller destabilisere mellemprodukter.
* ph: Miljøets surhed eller grundlæggende kan påvirke ioniseringstilstanden for funktionelle grupper, der påvirker deres reaktivitet.
* katalysator: En katalysator sænker aktiveringsenergien for en reaktion og fremskynder processen uden at blive konsumeret.
4. Termodynamik:
* entalpiændring (ΔH): Ændringen i varmeenergi under en reaktion; Eksoterme reaktioner frigiver varme og er mere gunstige.
* entropiændring (ΔS): Ændringen i lidelse under en reaktion; Reaktioner, der øger lidelsen, er mere gunstige.
* gibbs fri energi (ΔG): Et mål for spontaniteten af en reaktion; En negativ ΔG indikerer en spontan reaktion.
Sammenfattende bestemmes reaktiviteten af et molekyle af et komplekst samspil mellem dens struktur, elektroniske egenskaber og miljøfaktorer. At forstå disse faktorer er afgørende for at forudsige og kontrollere kemiske reaktioner.
 Varme artikler
Varme artikler
-
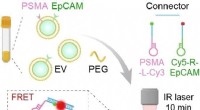 Hurtig, ukompliceret og specifik:Diagnose af prostatacancer fra blodprøverGrafisk abstrakt. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202207037 Tidlig opdagelse af prostatacancer, en af de mest almindelige kræftformer hos mænd, opnås ofte
Hurtig, ukompliceret og specifik:Diagnose af prostatacancer fra blodprøverGrafisk abstrakt. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202207037 Tidlig opdagelse af prostatacancer, en af de mest almindelige kræftformer hos mænd, opnås ofte -
 Afsaltning kan hjælpe ingeniører med at producere rent vand mere effektivtKredit:CC0 Public Domain Et hold ledet af forskere fra Imperial College London undersøgte, hvordan vandmolekyler bevæger sig i et begrænset rum - i dette tilfælde gennem en polyamid (PA) membran, d
Afsaltning kan hjælpe ingeniører med at producere rent vand mere effektivtKredit:CC0 Public Domain Et hold ledet af forskere fra Imperial College London undersøgte, hvordan vandmolekyler bevæger sig i et begrænset rum - i dette tilfælde gennem en polyamid (PA) membran, d -
 Forskere skaber fotoniske materialer til kraftfuld, effektiv lysbaseret databehandlingKredit:CC0 Public Domain Forskere fra University of Central Florida udvikler nye fotoniske materialer, der en dag kan hjælpe med at muliggøre laveffekt, ultrahurtig, lys-baseret databehandling. De
Forskere skaber fotoniske materialer til kraftfuld, effektiv lysbaseret databehandlingKredit:CC0 Public Domain Forskere fra University of Central Florida udvikler nye fotoniske materialer, der en dag kan hjælpe med at muliggøre laveffekt, ultrahurtig, lys-baseret databehandling. De -
 En uventet virkemåde for et antistofFor at illustrere den funktionelle mimik opdaget i antistoffer mod SARS-coronavirus, en mime holder i hånden SARS-CoV S bundet til ACE2-receptoren (blågrøn). Hans refleksion viser et SARS-CoV S bundet
En uventet virkemåde for et antistofFor at illustrere den funktionelle mimik opdaget i antistoffer mod SARS-coronavirus, en mime holder i hånden SARS-CoV S bundet til ACE2-receptoren (blågrøn). Hans refleksion viser et SARS-CoV S bundet
- Hvor mange miles er troposfæren fra jorden?
- Lyse områder på Ceres tyder på geologisk aktivitet
- Jeg dyrker bakterier og disse hvide fuzzy ting oven på det. Er det også det eller er det noget and…
- Hvordan spiser rhizopus?
- Hvad er betydningen af en måneregnbuering i folklore og mytologi?
- Udforsker fremmedhed og det oprindelige univers


