Hvad er to måder hastigheden på en kemisk reaktion kan øges, hvis begge reaktanter vandige opløsninger?
1. Stigende temperatur:
* Forklaring: At hæve temperaturen giver molekyler mere kinetisk energi. Dette betyder, at de bevæger sig hurtigere og kolliderer oftere. Vigtigere er det, at kollisionerne er mere energiske, hvilket gør det mere sandsynligt, at de vil overvinde aktiveringsenergibarrieren og reagere.
* Eksempel: Opvarmning af en opløsning af bagepulver (natriumbicarbonat) og eddike (eddikesyre) vil få reaktionen til at producere kuldioxidgas meget hurtigere.
2. Stigende koncentration:
* Forklaring: En højere koncentration af reaktanter betyder, at der er flere reaktantmolekyler til stede i samme volumen. Dette fører til en større sandsynlighed for kollisioner mellem reaktantmolekyler, hvilket resulterer i mere succesrige reaktioner.
* Eksempel: Tilsætning af mere bagepulver til et fast volumen eddike vil resultere i en hurtigere reaktionshastighed, da der er flere natriumbicarbonatmolekyler til rådighed til reaktion med eddikesyren.
 Varme artikler
Varme artikler
-
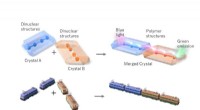 Linkede lanthanider skinner lys på krystalteknikNår blåt lys skinner på dysprosiumenden af forbundne lanthanidkrystaller (blå krystal), lyser terbiumenden (orange krystal) grønt. Dette sammenlignes med et tog, der transporterer energi. Kredit:Ped
Linkede lanthanider skinner lys på krystalteknikNår blåt lys skinner på dysprosiumenden af forbundne lanthanidkrystaller (blå krystal), lyser terbiumenden (orange krystal) grønt. Dette sammenlignes med et tog, der transporterer energi. Kredit:Ped -
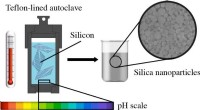 En miljøvenlig måde at omdanne silicium til nanopartiklerKredit:Skolkovo Institute of Science and Technology Skoltech -forskere og deres kolleger fra Lomonosov Moscow State University (MSU) har udviklet en ny metode til genbrug af silicium. Deres forskn
En miljøvenlig måde at omdanne silicium til nanopartiklerKredit:Skolkovo Institute of Science and Technology Skoltech -forskere og deres kolleger fra Lomonosov Moscow State University (MSU) har udviklet en ny metode til genbrug af silicium. Deres forskn -
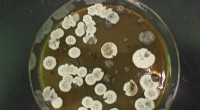 Når disse bakterier spiser, genererer de et usædvanligt trekantet molekyle, der kan bruges til at …Den almindelige bakterie streptomyces som laver de cyclopropanholdige molekyler. Kredit:Pablo Morales-Cruz Fly transporterer mennesker, sender varer og udfører militære operationer, men de oliebase
Når disse bakterier spiser, genererer de et usædvanligt trekantet molekyle, der kan bruges til at …Den almindelige bakterie streptomyces som laver de cyclopropanholdige molekyler. Kredit:Pablo Morales-Cruz Fly transporterer mennesker, sender varer og udfører militære operationer, men de oliebase -
 Et nyt potentielt alternativ til myggebekæmpelse opdagetKredit:CC0 Public Domain Naturlige æteriske olier udvundet af skallen af en citrusfrugt kunne være et effektivt nyt miljøvenligt alternativ i myggekontrolprogrammer, rapporterer en ny undersøgel
Et nyt potentielt alternativ til myggebekæmpelse opdagetKredit:CC0 Public Domain Naturlige æteriske olier udvundet af skallen af en citrusfrugt kunne være et effektivt nyt miljøvenligt alternativ i myggekontrolprogrammer, rapporterer en ny undersøgel
- Eksplosion i Tianjin Havn øgede atmosfærisk kvælstofaflejring over Bohai -havet
- Unormale svage værdier via en enkelt foton detektion
- Forskere studerer, hvorfor den blinde salamander lever så længe
- Video:En milliard stjerner og tæller - himlen ifølge Gaias anden dataudgivelse
- Har jeg brug for det? 'Underforbrugskerne'-tendenser på TikTok
- Ny tilgang viser løfte om at overvinde flaskehalsen med blå emission i skærme, der bruger OLED'er


