Hvad kan du gøre, hvis du enten vil få en kemisk reaktion til at ske hurtigere eller langsommere?
faktorer, der påvirker reaktionshastigheden
* Temperatur:
* Forøg temperaturen: Varmehastere reaktioner ved at tilvejebringe mere energi til molekyler til at kollidere og overvinde aktiveringsenergibarrierer.
* Eksempler:
* Madlavning af mad:Du bruger varme til at fremskynde de kemiske reaktioner, der koger din mad.
* Forbrænding:Brændende træ eller benzin er afhængig af varme for at starte og opretholde reaktionerne.
* Faldstemperatur: Sænkning af temperaturen bremser reaktionerne ned, fordi molekyler har mindre energi at kollidere.
* Eksempler:
* Køling:Opbevaring af mad i køleskab bremser de kemiske reaktioner, der forårsager ødelæggelse.
* Opbevaring af kemikalier:Mange kemikalier opbevares ved lave temperaturer for at forhindre dem i at reagere for hurtigt.
* Koncentration:
* Forøg koncentration: Højere koncentrationer betyder, at flere molekyler er til stede, hvilket fører til hyppigere kollisioner og en hurtigere reaktionshastighed.
* Eksempler:
* Brændende brændstof:Et mere koncentreret brændstof (som ren benzin) brænder hurtigere end et mindre koncentreret brændstof (som en brændstof-luftblanding).
* Enzymreaktioner:Højere koncentrationer af reaktanter vil føre til hurtigere enzymaktivitet.
* Fald koncentration: Nedre koncentrationer betyder, at færre molekyler er til stede, hvilket reducerer chancerne for kollisioner og bremser reaktionen.
* Eksempler:
* Fortynding af en opløsning:Fortynding af en syre vil bremse sin reaktion med et metal.
* Begrænsning af reaktanter:I en forbrændingsreaktion vil det at begrænse mængden af ilt bremse brændende proces.
* overfladeareal:
* Forøg overfladeareal: At bryde et fast stof i mindre stykker øger sit overfladeareal, hvilket giver flere steder for reaktanter at kollidere og reagere.
* Eksempler:
* Burning Wood:Kindling (små træstykker) brænder hurtigere end en stor bjælke på grund af det øgede overfladeareal.
* Pulveriseret sukker opløses hurtigere i vand end en sukkerterning.
* Fald overfladeareal: Store stykker af faste reaktanter har mindre overfladeareal, hvilket bremser reaktionen ned.
* Eksempler:
* Opbevaring af metaller:Metaller opbevares ofte i store, faste blokke for at forhindre hurtig oxidation.
* Kulforbrænding:En stor klump kul brænder langsommere end en bunke kulstøv.
* katalysator:
* Tilføj en katalysator: En katalysator fremskynder en reaktion uden at blive fortæret selv. Det giver en alternativ vej med en lavere aktiveringsenergi.
* Eksempler:
* Enzymer:Enzymer er biologiske katalysatorer, der fremskynder biokemiske reaktioner i levende organismer.
* Katalytiske omformere i biler:Disse omdanner skadelige forurenende stoffer til mindre skadelige gasser.
* Fjern en katalysator: Fjernelse af en katalysator vil bremse en reaktion.
* Eksempler:
* Forgiftning af en katalysator:Nogle stoffer kan "forgifte" en katalysator, hvilket gør den mindre effektiv.
* Fjernelse af enzymer:Denaturering af enzymer (f.eks. Med varme) vil bremse de reaktioner, de katalyserer.
* tryk (for reaktioner, der involverer gasser):
* Forøg presset: Forøgelse af trykket fra en reaktion, der involverer gasser, tvinger molekylerne tættere sammen, hvilket øger hyppigheden af kollisioner.
* Eksempler:
* Haber -proces (nitrogenfiksering):Højt tryk bruges til at favorisere dannelsen af ammoniak fra nitrogen- og brintgasser.
* Fald tryk: At reducere trykket reducerer hyppigheden af kollisioner og bremser reaktionen.
nøglepunkter at huske:
* Aktiveringsenergi: Reaktioner har brug for en vis mængde energi (aktiveringsenergi) for at starte. Faktorer som temperatur og katalysatorer kan sænke denne energibarriere.
* Kollisionsteori: Reaktioner forekommer, når reaktantmolekyler kolliderer med nok energi og i den rigtige orientering.
Fortæl mig, hvis du gerne vil have en mere detaljeret forklaring af nogen af disse faktorer eller have specifikke kemiske reaktioner i tankerne!
 Varme artikler
Varme artikler
-
 Et bionisk blad kunne hjælpe med at brødføde verdenRadiserne til højre blev dyrket ved hjælp af et bionisk blad, der producerer gødning med bakterier, sollys, vand og luft. Kredit:Nocera lab, Harvard Universitet I anden halvdel af det 20. århundre
Et bionisk blad kunne hjælpe med at brødføde verdenRadiserne til højre blev dyrket ved hjælp af et bionisk blad, der producerer gødning med bakterier, sollys, vand og luft. Kredit:Nocera lab, Harvard Universitet I anden halvdel af det 20. århundre -
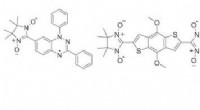 Overvindelse af udfordringerne med kontrolleret termisk aflejring af organiske diradikale stofferVenstre panel:Diradikalerne undersøgt i dette arbejde. Højre panel:Skitse af forskellige film (grøn farve) afsat på et underlag (grå farve). Kredit:Tuebingen Universitet Magnetisme er en egenskab
Overvindelse af udfordringerne med kontrolleret termisk aflejring af organiske diradikale stofferVenstre panel:Diradikalerne undersøgt i dette arbejde. Højre panel:Skitse af forskellige film (grøn farve) afsat på et underlag (grå farve). Kredit:Tuebingen Universitet Magnetisme er en egenskab -
 Ny beregningsmetode til lægemiddelopdagelseForsidebilledet illustrerer TauRAMD-metoden, som er baseret på Random Acceleration Molecular Dynamics-teknikken og designet til beregning af de relative opholdstider, tau, af lægemiddellignende forbin
Ny beregningsmetode til lægemiddelopdagelseForsidebilledet illustrerer TauRAMD-metoden, som er baseret på Random Acceleration Molecular Dynamics-teknikken og designet til beregning af de relative opholdstider, tau, af lægemiddellignende forbin -
 Molekylær modelleringskit i mikrometerstørrelse viser ægte kemiske reaktionerEn kunstners indtryk af nogle molekyler, der kan laves og studeres ved hjælp af det nye modelleringssæt. Kredit:Laura Quarto Molekyler er så små, at vi ikke engang kan se dem med almindelige mikro
Molekylær modelleringskit i mikrometerstørrelse viser ægte kemiske reaktionerEn kunstners indtryk af nogle molekyler, der kan laves og studeres ved hjælp af det nye modelleringssæt. Kredit:Laura Quarto Molekyler er så små, at vi ikke engang kan se dem med almindelige mikro
- Sådan konverteres Watt Timer pr. Meter Squared til Lux Hours
- Karakteristika for økosystemet
- Nanorods kunne i høj grad forbedre visuel visning af information (m/ video)
- Hvad kaldes det, når et mere reaktivt metal erstatter mindre i forbindelsen?
- Opbevaring af CO2 under jorden kan bremse kulstofemissioner, men er det sikkert?
- Vigtigheden af at redde oprindelige sprog


