Hvad er en korrekt beskrivelse af entalpi -reaktionen?
entalpi af reaktion:En korrekt beskrivelse
Entalpien af reaktionen, ofte symboliseret som ΔH, henviser til ændringen i entalpi Det forekommer under en kemisk reaktion. Det repræsenterer varmeenergi absorberet eller frigivet Under reaktionen under konstant tryk.
Her er en mere detaljeret sammenbrud:
* entalpi (H): Dette er en termodynamisk egenskab, der repræsenterer den samlede energi i et system, inklusive dets interne energi og produktet af dets tryk og volumen.
* Ændring i entalpi (ΔH): Det er forskellen i entalpi mellem produkter og reaktanter ved en reaktion.
* eksotermiske reaktioner: Disse reaktioner frigør varme ind i omgivelserne, hvilket resulterer i en negativ ΔH -værdi.
* endotermiske reaktioner: Disse reaktioner absorberer varme fra omgivelserne, hvilket resulterer i en positiv ΔH -værdi.
Nøglepunkter:
* Reaktionens entalpi er en tilstandsfunktion , hvilket betyder, at det kun afhænger af de oprindelige og endelige tilstande i systemet, ikke den sti, der er taget for at nå dem.
* Det udtrykkes typisk i joules (J) eller kilojoules (KJ) .
* Reaktionens entalpi er et nyttigt værktøj til at forudsige varmestrømmen forbundet med en reaktion og bestemmelse af dens gennemførlighed.
I resumé kvantificerer entalpien af reaktionen den varmeenergi, der udveksles mellem en kemisk reaktion og dens omgivelser.
Sidste artikelHvad er en korrekt beskrivelse af entalpi -reaktion?
Næste artikelHvorfor er anden elektronaffinitet for halogener nul?
 Varme artikler
Varme artikler
-
 Lille skala, store forbedringerKredit:George Hodan/public domain Metoder til at forbedre vandrensning eller bygge bedre batterier er problemer, som har udfordret videnskabsmænd i årtier. Fremskridtene er gået fremad, men stigen
Lille skala, store forbedringerKredit:George Hodan/public domain Metoder til at forbedre vandrensning eller bygge bedre batterier er problemer, som har udfordret videnskabsmænd i årtier. Fremskridtene er gået fremad, men stigen -
 At optrevle endnu en hemmelighed ved edderkoppesilke - det er et kabelHannes Schniepp (til venstre) og Qijue Wang brugte atomkraftmikroskopi til at bestemme, at den brune eneboer-edderkops netstrenge faktisk er nanofibre samlet til en flad, båndlignende kabel. Kredit:St
At optrevle endnu en hemmelighed ved edderkoppesilke - det er et kabelHannes Schniepp (til venstre) og Qijue Wang brugte atomkraftmikroskopi til at bestemme, at den brune eneboer-edderkops netstrenge faktisk er nanofibre samlet til en flad, båndlignende kabel. Kredit:St -
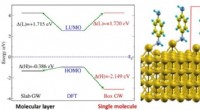 Energiniveaujustering for molekylær elektronik(Venstre) Figur viser elektronenerginiveaujusteringen af benzen-diaminmolekyler på guldoverfladesystemet (vist til højre). Energiniveauerne er vist for et molekylært lag (sort) og for et enkelt mole
Energiniveaujustering for molekylær elektronik(Venstre) Figur viser elektronenerginiveaujusteringen af benzen-diaminmolekyler på guldoverfladesystemet (vist til højre). Energiniveauerne er vist for et molekylært lag (sort) og for et enkelt mole -
 Bare tilsæt vand - Kemikere afslører en mekanisme bag doping af organiske halvledereDenne Lewis-syre ændrer de elektriske egenskaber af visse organiske halvledere, når den tilsættes i tilstedeværelsen af vand Kredit: Brett Yurash Halvledere – og vores beherskelse af dem – har g
Bare tilsæt vand - Kemikere afslører en mekanisme bag doping af organiske halvledereDenne Lewis-syre ændrer de elektriske egenskaber af visse organiske halvledere, når den tilsættes i tilstedeværelsen af vand Kredit: Brett Yurash Halvledere – og vores beherskelse af dem – har g


