Hvad er en korrekt beskrivelse af entalpi -reaktion?
entalpi af reaktion:En korrekt beskrivelse
entalpi af reaktion Henviser til Ændring i entalpi Det forekommer under en kemisk reaktion.
Her er en sammenbrud:
* entalpi (h) :En termodynamisk egenskab, der repræsenterer samlet varmeindhold af et system. Det inkluderer systemets interne energi plus produktet af tryk og volumen.
* Ændring i entalpi (ΔH) :Forskellen i entalpi mellem produkter og reaktanter ved en reaktion.
* eksotermiske reaktioner (ΔH <0) :Reaktioner, der frigiver varme ind i omgivelserne. Produkternes entalpi er lavere end reaktanternes entalpi.
* endotermiske reaktioner (ΔH> 0) :Reaktioner, der absorberer varme fra omgivelserne. Produkternes entalpi er højere end reaktanternes entalpi.
Sammenfattende fortæller entalpien af reaktion os, om en reaktion frigiver eller absorberer varme, og ved hvor meget.
Her er nogle vigtige punkter at huske:
* Entalpi af reaktion er en tilstandsfunktion , hvilket betyder, at det kun afhænger af de oprindelige og endelige tilstande i systemet, ikke den sti, der er taget.
* Reaktionens entalpi kan beregnes ud fra entalpierne for dannelse af reaktanter og produkter.
* Entalpi af reaktion er et nyttigt værktøj For at forudsige, om en reaktion vil forekomme spontant eller ej.
Eksempel:
Forbrændingen af methan (CH4) er en eksoterm reaktion med en negativ entalpi af reaktion (-890 kJ/mol). Dette betyder, at 890 kJ varme frigøres pr. Mol brændt metan.
Ligning:
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (l) ΔH =-890 kJ/mol
Denne information hjælper os med at forstå, at denne reaktion frigiver varme, og derfor bruges den som brændstofkilde.
 Varme artikler
Varme artikler
-
 Forskere udvikler syntetiske stilladser til at helbrede skadede sener og ledbåndForskningen håber at forbedre resultaterne af sportsskadeoperationer. Kredit:Pixabay Australiens kærlighed til sport betyder, at det har en af de højeste forekomster af forreste korsbånd (ACL) s
Forskere udvikler syntetiske stilladser til at helbrede skadede sener og ledbåndForskningen håber at forbedre resultaterne af sportsskadeoperationer. Kredit:Pixabay Australiens kærlighed til sport betyder, at det har en af de højeste forekomster af forreste korsbånd (ACL) s -
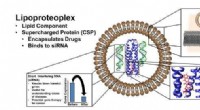 Forskere skaber biomateriale, der leverer både et kraftfuldt lægemiddel og gendæmpereLipoproteoplex bruger en lipid-beholder til transfektion - transport af materiale forbi en cellemembran - og en proteinkapsel, der er nem at fremstille, der kan binde både små molekyle kemoterapeutisk
Forskere skaber biomateriale, der leverer både et kraftfuldt lægemiddel og gendæmpereLipoproteoplex bruger en lipid-beholder til transfektion - transport af materiale forbi en cellemembran - og en proteinkapsel, der er nem at fremstille, der kan binde både små molekyle kemoterapeutisk -
 Nyt materiale gør køleudstyr mere energieffektiveTil deres prøver, de dækkede en konventionel varmeveksler (som brugt i kommercielt køleudstyr) med det nye materiale, i samarbejde med kolleger fra Fraunhofer Institute for Solar Energy Systems. Kredi
Nyt materiale gør køleudstyr mere energieffektiveTil deres prøver, de dækkede en konventionel varmeveksler (som brugt i kommercielt køleudstyr) med det nye materiale, i samarbejde med kolleger fra Fraunhofer Institute for Solar Energy Systems. Kredi -
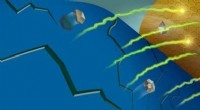 Forskere identificerer kemiske årsager til, at batterikapaciteten falmerNår manganioner (grå) fjernes fra et batteris katode (blå), de kan reagere med batteriets elektrolyt nær anoden (guld), indfangning af lithium-ioner (grøn/gul). Kredit:Robert Horn/Argonne National Lab
Forskere identificerer kemiske årsager til, at batterikapaciteten falmerNår manganioner (grå) fjernes fra et batteris katode (blå), de kan reagere med batteriets elektrolyt nær anoden (guld), indfangning af lithium-ioner (grøn/gul). Kredit:Robert Horn/Argonne National Lab
- Orkanen Ida rammer Louisiana som kategori 4-storm
- Gennembrud mod mere kraftfulde partikelacceleratorer
- Rwandas æteriske olier giver store overskud fra lille jord
- Hvad er 3 eksempler på fysiske ressourcer og deres vedligeholdelse?
- Næste generations enheder får et løft fra forskning i grafen
- Små porer i grafen kan give anledning til nye membraner, der kan filtrere vand eller adskille biolo…


