Hvordan påvirker tilstedeværelsen af en katalysator enthalpi -ændringsreaktion?
* entalpiændring repræsenterer forskellen i energi mellem reaktanter og produkter. Det er en termodynamisk egenskab, der afhænger af de indledende og endelige tilstande for reaktionen.
* katalysatorer giver en alternativ reaktionsvej med en lavere aktiveringsenergi. De fremskynder reaktionen ved at sænke energibarrieren, som reaktanter har brug for at overvinde for at danne produkter.
* Den samlede energiændring (ΔH) forbliver den samme. Mens katalysatoren sænker aktiveringsenergien, ændrer den ikke energiniveauet for reaktanterne eller produkterne. Forskellen i energi mellem dem og dermed ΔH forbliver konstant.
Analogi:
Forestil dig en bakke mellem to punkter, A og B. Forskellen i højden mellem A og B repræsenterer entalpiændringen. En katalysator er som at bygge en tunnel gennem bakken. Tunnelen gør det lettere at rejse mellem A og B, men det ændrer ikke den samlede højdeforskel.
Kortfattet:
* Katalysatorer fremskynder reaktionerne.
* Katalysatorer sænker aktiveringsenergien.
* Katalysatorer påvirker ikke enthalpiændringen (ΔH) af en reaktion.
 Varme artikler
Varme artikler
-
 Angriber bakterier med hajhud-inspirerede overfladerKredit:American Chemical Society Hajer er ofte genstand for tv-specialiteter eller nyhedshistorier, der fokuserer på deres angreb på mennesker. Men forskere finder ud af, at hajer kan inspirere ti
Angriber bakterier med hajhud-inspirerede overfladerKredit:American Chemical Society Hajer er ofte genstand for tv-specialiteter eller nyhedshistorier, der fokuserer på deres angreb på mennesker. Men forskere finder ud af, at hajer kan inspirere ti -
 Det værdifulde bidrag fra stress til den termiske stabilitet af nanokornede polykrystallinske leger…Kredit:CC0 Public Domain Nanokornede metaller og legeringer, hvis kornstørrelse er mindre end 100 nm, udviser ekstrem høj styrke og høj duktilitet, har fremragende mekaniske egenskaber. Nanokorned
Det værdifulde bidrag fra stress til den termiske stabilitet af nanokornede polykrystallinske leger…Kredit:CC0 Public Domain Nanokornede metaller og legeringer, hvis kornstørrelse er mindre end 100 nm, udviser ekstrem høj styrke og høj duktilitet, har fremragende mekaniske egenskaber. Nanokorned -
 Højtydende enkeltatomkatalysatorer til høj temperatur brændselscellerKonceptuelt diagram over enkeltatomskatalysator udviklet af KIST -forskere. Kredit:Korea Institue of Science and Technology (KIST) I modsætning til sekundære batterier, der skal genoplades, brænds
Højtydende enkeltatomkatalysatorer til høj temperatur brændselscellerKonceptuelt diagram over enkeltatomskatalysator udviklet af KIST -forskere. Kredit:Korea Institue of Science and Technology (KIST) I modsætning til sekundære batterier, der skal genoplades, brænds -
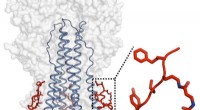 Forskere udvikler bredspektrede hæmmere af influenzavirusJanssen- og TSRI-holdene designede og karakteriserede et potent peptid, der efterlignede funktionaliteten af et bredt neutraliserende antistof, og som også var i stand til at målrette influenzavirus
Forskere udvikler bredspektrede hæmmere af influenzavirusJanssen- og TSRI-holdene designede og karakteriserede et potent peptid, der efterlignede funktionaliteten af et bredt neutraliserende antistof, og som også var i stand til at målrette influenzavirus
- Er din kaffe 'ikke varm' eller 'kold'? At observere, hvordan hjernen behandler negerede adjektiver
- ECB vil starte nedtællingen på nye stimulanser i euroområdet
- Mærkelig vridningsgeometri hjælper med at skubbe videnskabelige grænser
- Selektiv aflivning af kræftceller ved at ødelægge deres affaldsbortskaffelsessystem
- Sådan læser du et STEREO-billede
- Journalister smækker i afventende lov om digital sikkerhed i Bangladesh


