Hvordan fører øget overfladeareal af en reaktant i kemisk reaktion til hurtigere reaktion?
1. Kollisionsteori
* reaktioner forekommer, når molekyler kolliderer med nok energi til at bryde bindinger og danne nye.
* overfladeareal dikterer antallet af potentielle kollisionspunkter.
2. Forøget overfladeareal =flere kollisionssteder
* Forestil dig en solid blok af sukker. Det har et lille overfladeareal udsat for luft.
* Knus det sukker i pulver. Pulveret har et meget øget overfladeareal.
* pulveret har flere punkter, hvor molekyler fra luften (som ilt) kan kollidere med sukkermolekyler.
3. Hurtigere reaktioner
* Flere kollisioner betyder en større chance for vellykkede kollisioner (dem med nok energi til at reagere).
* Dette fører til en hurtigere reaktionshastighed.
Eksempler:
* forbrænding af en bjælke vs. savsmuld: Sawdust brænder meget hurtigere, fordi det har et markant større overfladeareal.
* opløste sukker: Granuleret sukker opløses hurtigere end en sukkerterning, fordi de mindre granuler har et større overfladeareal udsat for vand.
* katalysatorer: Mange katalysatorer fungerer ved at øge det overfladeareal, der er tilgængeligt for reaktanter til at interagere, hvilket fremskynder reaktionen.
Vigtig note: Forøgelse af overfladeareal er ikke den eneste faktor, der påvirker reaktionshastigheden. Temperatur, koncentration og tilstedeværelsen af katalysatorer spiller også betydelige roller.
 Varme artikler
Varme artikler
-
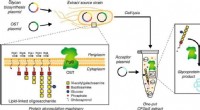 Bioingeniører skaber vej til personlig medicinSkematisk af enkelt-pot CFGpS-teknologi. Glycoengineered E. coli, der er modificeret med (i) genomiske mutationer, der gavner glykosyleringsreaktioner og (ii) plasmid -DNA til fremstilling af essentie
Bioingeniører skaber vej til personlig medicinSkematisk af enkelt-pot CFGpS-teknologi. Glycoengineered E. coli, der er modificeret med (i) genomiske mutationer, der gavner glykosyleringsreaktioner og (ii) plasmid -DNA til fremstilling af essentie -
 Et hurtigt malariatest -kit, der kan hjælpe diagnosen i udviklingslandeEt nærbillede af en prototype af det NTU-udviklede hurtige malariatestsæt. Kredit:NTU Singapore Et team af forskere fra Nanyang Technological University, Singapore (NTU Singapore) har udviklet et
Et hurtigt malariatest -kit, der kan hjælpe diagnosen i udviklingslandeEt nærbillede af en prototype af det NTU-udviklede hurtige malariatestsæt. Kredit:NTU Singapore Et team af forskere fra Nanyang Technological University, Singapore (NTU Singapore) har udviklet et -
 Kan du lave en 10-årig maltwhisky på uger? Kemien siger jaVille du stadig være villig til at vente på whisky? Kredit:Shutterstock.com I løbet af de sidste par år er whisky-drikkende verden blevet introduceret til adskillige nye produkter, der hævder at p
Kan du lave en 10-årig maltwhisky på uger? Kemien siger jaVille du stadig være villig til at vente på whisky? Kredit:Shutterstock.com I løbet af de sidste par år er whisky-drikkende verden blevet introduceret til adskillige nye produkter, der hævder at p -
 Sollys-drevet fotokatalytisk vandopdeling til brintproduktion i stor skalaPanoramaudsigt over brintproduktionens fotokatalytiske panelreaktionssystem. Kredit:Tilpasset fra Nishiyama, H., Yamada, T., Nakabayashi, M. et al. Storstilet solbrintproduktion gennem vandopdelin
Sollys-drevet fotokatalytisk vandopdeling til brintproduktion i stor skalaPanoramaudsigt over brintproduktionens fotokatalytiske panelreaktionssystem. Kredit:Tilpasset fra Nishiyama, H., Yamada, T., Nakabayashi, M. et al. Storstilet solbrintproduktion gennem vandopdelin
- USA udsender hackingsikkerhedsalarm til små fly
- Guldnanopartikler og teforbindelse behandler prostatacancer med færre bivirkninger end kemoterapi
- Hvad er undersøgelsen af arvelighed?
- Den første binding i et kovalent molekyle er altid sigmabindingen?
- Forskere finder ud af, hvordan mystisk 'cirkulært RNA' dannes, hævder muskeldystrofiforbindelse
- Undersøgelse siger, at en varmere verden sandsynligvis har gjort dødbringende regnskyl fra Dubai t…


