Hvad kan du beregne, hvis du kender koncentrationen af et produkter og reaktanter såvel som koefficienter hver i afbalanceret ligning?
1. Ligevægtskonstant (K):
* Ligevægtskonstanten (K) er en værdi, der udtrykker forholdet mellem produkter og reaktanter i ligevægt.
* Du kan beregne k ved hjælp af loven om massehandling:
* k =[Produkter]^Koefficienter / [Reaktanter]^Koefficienter
* Hvor [] repræsenterer den molære koncentration af hver art.
2. Reaktionskvotient (Q):
* Reaktionskvotienten (Q) ligner K, men den kan på ethvert tidspunkt beregnes i reaktionen, ikke kun ved ligevægt.
* Det fortæller dig de relative mængder produkter og reaktanter på et givet tidspunkt.
* q =[Produkter]^Koefficienter / [Reaktanter]^Koefficienter
3. Gibbs Free Energy Change (ΔG):
* Gibbs frie energiændring (ΔG) indikerer spontaniteten af en reaktion.
* Du kan beregne ΔG ved hjælp af ligningen:
* ΔG =-rtlnk
* Hvor R er den ideelle gaskonstant, er T temperaturen i Kelvin, og K er ligevægtskonstanten.
4. Standard Gibbs Free Energy Change (ΔG °):
* Standard Gibbs Free Energy Change (ΔG °) er Gibbs Free Energy -ændringen under standardbetingelser (298 K og 1 atm).
* Du kan beregne ΔG ° ved hjælp af ligningen:
* ΔG ° =-rtlnk °
* Hvor K ° er ligevægtskonstanten under standardbetingelser.
5. Færdiggørelsesgrad:
* Du kan bestemme, i hvilket omfang en reaktion er gået videre med at sammenligne de indledende og slutkoncentrationer af reaktanter og produkter.
* Dette kan bruges til at beregne procentdelen af reaktionen.
6. Bedømte konstant (k):
* Hvis reaktionen er reversibel, kan du bruge ligevægtskonstanten (K) og hastighedskonstanterne for de fremadrettede (KF) og omvendte (KR) reaktioner til at bestemme de individuelle hastighedskonstanter:
* k =kf / kr
7. Aktiveringsenergi (EA):
* Du kan bruge Arrhenius -ligningen til at beregne aktiveringsenergien (EA) af en reaktion, hvis du kender hastighedskonstanten ved to forskellige temperaturer:
* k =ae^(-ea/rt)
* Hvor A er den præ-eksponentielle faktor, er R den ideelle gaskonstant, og T er temperaturen i Kelvin.
Bemærk: Disse beregninger antager, at reaktionen er i ligevægt, eller at koncentrationerne af produkter og reaktanter er kendt på et specifikt tidspunkt.
Sidste artikelÆndrer det at tage vand ud af en ligevægtsreaktion konstanten?
Næste artikelHvad er det samlede volumen saltvand i gallon?
 Varme artikler
Varme artikler
-
 Forskere opdager en grønnere vej til udbredt industrielt materialeKredit:Pixabay/CC0 Public Domain Forskere fra Cardiff University har taget et skridt mod en grønnere, mere bæredygtig måde at skabe et plastmateriale, der findes i en række genstande fra tandbørste
Forskere opdager en grønnere vej til udbredt industrielt materialeKredit:Pixabay/CC0 Public Domain Forskere fra Cardiff University har taget et skridt mod en grønnere, mere bæredygtig måde at skabe et plastmateriale, der findes i en række genstande fra tandbørste -
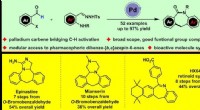 Modulær tilgang til dibenzo-fusionerede ε-lactamer gennem carbene-brodannende CH-aktiveringPalladiumkatalyseret adgang til dibenzo-fusionerede ε-lactamer og applikationen. Kredit:Prof. HUANGs gruppe På grund af deres spændende biologiske aktiviteter og potentielle anvendelighed til at t
Modulær tilgang til dibenzo-fusionerede ε-lactamer gennem carbene-brodannende CH-aktiveringPalladiumkatalyseret adgang til dibenzo-fusionerede ε-lactamer og applikationen. Kredit:Prof. HUANGs gruppe På grund af deres spændende biologiske aktiviteter og potentielle anvendelighed til at t -
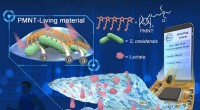 Fleksibel bioelektronisk enhed baseret på levende materiale til overvågning af laktat- og tumorcel…Skematisk diagram af PMNT-baseret levende materiale og bioelektronisk enhed til overvågning af laktat i fysiologiske væsker (sved, urin og plasma) og tælling af tumorceller. Kredit:Wang Zenghao Eft
Fleksibel bioelektronisk enhed baseret på levende materiale til overvågning af laktat- og tumorcel…Skematisk diagram af PMNT-baseret levende materiale og bioelektronisk enhed til overvågning af laktat i fysiologiske væsker (sved, urin og plasma) og tælling af tumorceller. Kredit:Wang Zenghao Eft -
 Nye forbindelser med anticarcinogene forbindelser syntetiseretInmaculada Fernández og Rocío Recio og Noureddine Khiar. Kredit:CSIC Stereokemi og asymmetrisk syntesegruppe ved Det Farmaceutiske Fakultet ved University of Sevilla, i samarbejde med Asymmetric S
Nye forbindelser med anticarcinogene forbindelser syntetiseretInmaculada Fernández og Rocío Recio og Noureddine Khiar. Kredit:CSIC Stereokemi og asymmetrisk syntesegruppe ved Det Farmaceutiske Fakultet ved University of Sevilla, i samarbejde med Asymmetric S
- Er nitratforbindelser uopløselige og danner bundfald?
- Forskere udvikler hukommelse på flere niveauer til forbrugerelektronik
- Definer kvanteudbytte af en fotokemisk reaktion?
- Atomisk bæltebane kunne løse problemer med kosmisk tyngdekraft
- Sådan starter du Ferskvandsrejer Farming
- Sådan konverteres procent til Decimal


