Er NH4NO3 N2O H2O en uforholdsmæssig reaktion?
Disproportioneringsreaktion: En uforholdsmæssig reaktion er en redoxreaktion, hvor det samme element gennemgår både oxidation og reduktion.
analyse af reaktionen:
* nh₄no₃ → N₂O + 2H₂O
1. nitrogen i nh₄no₃: Nitrogen har en oxidationstilstand på -3 i ammonium (NH₄⁺) og +5 i nitrat (NO₃⁻).
2. nitrogen i N₂O: Nitrogen har en oxidationstilstand på +1 i nitrogenoxid (N₂O).
3. nitrogen i H₂O: Kvælstof er ikke til stede i vand.
Observation: I denne reaktion er nitrogen i reaktanten (NH₄no₃) til stede i to forskellige oxidationstilstande (-3 og +5). I produktet har nitrogen (N₂O) en oxidationstilstand på +1. Dette betyder:
* nitrogen i ammonium (NH₄⁺) oxideres: Fra -3 til +1.
* nitrogen i nitrat (ingen₃⁻) reduceres: Fra +5 til +1.
Konklusion: Da det samme element (nitrogen) gennemgår både oxidation og reduktion i reaktionen, klassificeres det som en uforholdsmæssig reaktion.
 Varme artikler
Varme artikler
-
 Elektrisk fosfatsignatur hjælper med at registrere vigtige cellulære hændelserGrafisk abstrakt. Kredit:Tokyo Tech Hver dag forekommer millioner af biologiske processer i vores krop på cellulært niveau. At studere disse processer kan hjælpe os med at lære mere om, hvordan cel
Elektrisk fosfatsignatur hjælper med at registrere vigtige cellulære hændelserGrafisk abstrakt. Kredit:Tokyo Tech Hver dag forekommer millioner af biologiske processer i vores krop på cellulært niveau. At studere disse processer kan hjælpe os med at lære mere om, hvordan cel -
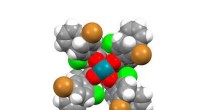 Nye syntesemetoder forbedrer 3-D kemisk plads til lægemiddelopdagelseGrafisk viser den udviklede dirhodium-katalysator, der bruges til at syntetisere et 3D-stillads af stor interesse for den farmaceutiske industri. Davies-laboratoriet har udgivet en række store artikle
Nye syntesemetoder forbedrer 3-D kemisk plads til lægemiddelopdagelseGrafisk viser den udviklede dirhodium-katalysator, der bruges til at syntetisere et 3D-stillads af stor interesse for den farmaceutiske industri. Davies-laboratoriet har udgivet en række store artikle -
 Forskere rapporterer om en ny metode til karakterisering af materialer, der i sidste ende kan hjælp…Nye karakteriseringsteknikker udviklet på Catalysis Center for Energy Innovation kan hjælpe med at forbedre elektrokemiske lagringsteknologier, såsom brændselsceller, der bruges i UDs brintbrændstofce
Forskere rapporterer om en ny metode til karakterisering af materialer, der i sidste ende kan hjælp…Nye karakteriseringsteknikker udviklet på Catalysis Center for Energy Innovation kan hjælpe med at forbedre elektrokemiske lagringsteknologier, såsom brændselsceller, der bruges i UDs brintbrændstofce -
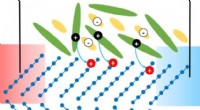 Konvertering af kropsvarme til elektricitet:Et skridt nærmere mod højtydende organisk termoelektri…Skematisk illustration af modulationsdopingprocessen og generering af termisk spænding. Kredit:Shu-Jen Wang Kan du forestille dig at oplade din mobiltelefon ved blot at bruge din kropsvarme? Det ly
Konvertering af kropsvarme til elektricitet:Et skridt nærmere mod højtydende organisk termoelektri…Skematisk illustration af modulationsdopingprocessen og generering af termisk spænding. Kredit:Shu-Jen Wang Kan du forestille dig at oplade din mobiltelefon ved blot at bruge din kropsvarme? Det ly
- Hurtige bevægelige partikler og energi frigivet af ustabile kerner er former for?
- Sådan forvandler du plastikaffald i din papirkurv til profit
- Bevis på fononkiralitet fra urenhedsspredning i den antiferromagnetiske isolator strontium iridiumo…
- Nyt aspekt af atommimik til nanoteknologiapplikationer
- Sådan fungerer dating
- Små vibrationsdrevne robotter på størrelse med verdens mindste myre


