Hvad sker der, når sukker opløses i vand?
1. attraktion: Sukkermolekyler (saccharose) er polære, hvilket betyder, at de har en lidt positiv og en lidt negativ ende. Vandmolekyler er også polære. Disse modsatte anklager tiltrækker hinanden.
2. Breaking Bonds: Vandmolekylerne omgiver sukkermolekylerne og bryder bindingerne, der holder sukkermolekylerne sammen i en krystalstruktur.
3. solvation: Sukkermolekylerne bliver omgivet af vandmolekyler og danner en opløsning. Sukkermolekylerne spredes nu jævnt i hele vandet.
4. Ingen kemisk ændring: Selve sukkermolekylerne har ikke ændret sig kemisk. De er bare adskilt og omgivet af vandmolekyler. Hvis du skulle fordampe vandet, ville du få dit originale sukker tilbage.
her er en simpel analogi:
Forestil dig en sukkerkrystall som en gruppe mennesker, der holder hænder. Vandmolekylerne er som venlige fremmede, der kommer med og begynder at tale med hver enkelt person i gruppen. Til sidst er folk i gruppen alle adskilt og chatter med de fremmede, men de er stadig de samme mennesker, bare ikke længere holder hænder.
Nøglepunkter:
* opløselighed: Sukker er opløseligt i vand på grund af den stærke tiltrækning mellem de polære vandmolekyler og de polære sukkermolekyler.
* Temperatur: Opløseligheden af sukker i vand øges med temperaturen. Dette skyldes, at højere temperaturer giver vandmolekyler mere energi til at bryde bindingerne, der holder sukkermolekylerne sammen.
* mætning: Du kan kun opløse så meget sukker i en given mængde vand. Når vandet ikke kan opløses mere sukker, siges opløsningen at være mættet.
Sidste artikelDestillation er en proces, der kan adskille to væsker ved hjælp af hvad?
Næste artikelHvordan opløses en solid til væske?
 Varme artikler
Varme artikler
-
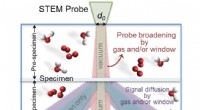 Bestemmelse af parametrene for transmissionselektronmikroskopiGaseffekter på spredning af hurtige elektroner, der bidrager til ESTEM -sonden og signalet. Kredit:Pacific Northwest National Laboratory Selvom telefonerne i vores lommer måske er perfekte til at
Bestemmelse af parametrene for transmissionselektronmikroskopiGaseffekter på spredning af hurtige elektroner, der bidrager til ESTEM -sonden og signalet. Kredit:Pacific Northwest National Laboratory Selvom telefonerne i vores lommer måske er perfekte til at -
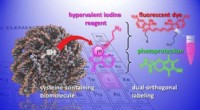 Nye kemiske værktøjer til at modificere og studere biomolekylerEn illustration af den kemiske reaktion udviklet i undersøgelsen. Kredit:J. Waser/B. Fierz (EPFL) Forståelse af strukturen og metabolismen af celler og levende organismer er afgørende for udvikl
Nye kemiske værktøjer til at modificere og studere biomolekylerEn illustration af den kemiske reaktion udviklet i undersøgelsen. Kredit:J. Waser/B. Fierz (EPFL) Forståelse af strukturen og metabolismen af celler og levende organismer er afgørende for udvikl -
 Forskere udvikler kunstig fotosyntesenhed til grønnere produktion af ethylenKredit:National University of Singapore Et team af videnskabsmænd fra National University of Singapore (NUS) har udviklet en prototype enhed, der efterligner naturlig fotosyntese for at producere
Forskere udvikler kunstig fotosyntesenhed til grønnere produktion af ethylenKredit:National University of Singapore Et team af videnskabsmænd fra National University of Singapore (NUS) har udviklet en prototype enhed, der efterligner naturlig fotosyntese for at producere -
 Faststofkatalyse:Udsving baner vejenKredit:CC0 Public Domain Brugen af effektive katalytiske midler er det, der gør mange tekniske procedurer mulige i første omgang. Ja, syntese af mere end 80 procent af de produkter, der generere
Faststofkatalyse:Udsving baner vejenKredit:CC0 Public Domain Brugen af effektive katalytiske midler er det, der gør mange tekniske procedurer mulige i første omgang. Ja, syntese af mere end 80 procent af de produkter, der generere
- Europæisk alliance vil investere op til 6 mia. euro i batterier til elbiler
- Overtrumfer det politiske parti ideologi?
- December komet bringer Rosetta minder tilbage
- Uddybende spørgsmål:Hvorfor tordenvejr det ikke om vinteren?
- Hvad skete der før Big Bang?
- Hvordan er teknologien ansvarlig for rumforurening?


