Når man øger koncentrationen og øget temp, øger begge reaktionshastigheder baseret på hvilket fysisk fænomen?
Her er en sammenbrud:
* Koncentration: Når du øger koncentrationen af reaktanter, pakker du i det væsentlige flere molekyler i det samme rum. Dette betyder, at der er flere muligheder for kollisioner mellem reaktantmolekylerne. Flere kollisioner oversætter til en større chance for vellykkede kollisioner (dem, der fører til produktdannelse), hvilket resulterer i en hurtigere reaktionshastighed.
* Temperatur: Forøgelse af temperaturen giver molekyler mere kinetisk energi, hvilket får dem til at bevæge sig hurtigere og kollidere oftere. Endvidere betyder den højere energi også, at flere kollisioner vil have tilstrækkelig energi til at overvinde aktiveringsenergibarriere og danne produkter. Denne kombination af øget frekvens og højere energikollisioner fører til en hurtigere reaktionshastighed.
I det væsentlige fører både øget koncentration og temperatur til hyppigere og mere energiske kollisioner, som er drivkraften bag kemiske reaktioner.
 Varme artikler
Varme artikler
-
 Uventet nyt materiale er slukket til omgivelsestrykAlena Ponomareva og Igor Abrikosov, forfattere fra NUST MISIS diskuterer de grafiske resultater af den teoretiske modeling. Kredit:© NUST MISIS Forskere fra National University of Science and Tech
Uventet nyt materiale er slukket til omgivelsestrykAlena Ponomareva og Igor Abrikosov, forfattere fra NUST MISIS diskuterer de grafiske resultater af den teoretiske modeling. Kredit:© NUST MISIS Forskere fra National University of Science and Tech -
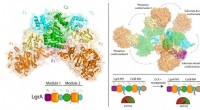 Ny forståelse af antibiotikasynteseKredit:McGill University Forskere ved McGill Universitys medicinske fakultet har gjort vigtige fremskridt med at forstå funktionen af enzymer, der spiller en integreret rolle i produktionen af
Ny forståelse af antibiotikasynteseKredit:McGill University Forskere ved McGill Universitys medicinske fakultet har gjort vigtige fremskridt med at forstå funktionen af enzymer, der spiller en integreret rolle i produktionen af -
 Undersøgelse afslører en kontinuerlig vej til livets byggestenGenerering af målmolekyler, der er relevante for livets oprindelse i et komplekst kemisk netværk drevet af stråling. Kredit:Ruiqin Yi, ELSI Forskere har længe søgt at forstå oprindelsen af liv p
Undersøgelse afslører en kontinuerlig vej til livets byggestenGenerering af målmolekyler, der er relevante for livets oprindelse i et komplekst kemisk netværk drevet af stråling. Kredit:Ruiqin Yi, ELSI Forskere har længe søgt at forstå oprindelsen af liv p -
 Selvemitterede overfladebølger i dynamisk brud af siliciumenkeltkrystalDynamisk revnefrontadfærd i steady-state (110) spaltning af de enkeltkrystallinske siliciumprøver under ren bøjning. (A) Morfologier af (110) spaltningsplanet (xy-planet) af de as-sawne prøver ved for
Selvemitterede overfladebølger i dynamisk brud af siliciumenkeltkrystalDynamisk revnefrontadfærd i steady-state (110) spaltning af de enkeltkrystallinske siliciumprøver under ren bøjning. (A) Morfologier af (110) spaltningsplanet (xy-planet) af de as-sawne prøver ved for
- Mere remstramning hos VW for at finansiere elektrisk nystart
- Hvordan integrerer lærere STEM i K-12 klasseværelser?
- Superledning i high-Tc cuprates:'Fra maksimal til minimal dissipation' - et nyt paradigme?
- Mineraler lavet af kun et element?
- Vil jordskælv nogensinde være forudsigelige?
- Fakta om Wisconsin Fast Plants


