Hvorfor har alkohol et højere kogepunkt end vand?
Her er hvorfor:
* Hydrogenbinding: Vandmolekyler danner stærke brintbindinger med hinanden. Disse obligationer kræver en masse energi for at bryde, hvilket fører til et højere kogepunkt.
* molekylær størrelse og masse: Mens alkoholmolekyler er større og tungere end vandmolekyler, danner de ikke som stærke brintbindinger. Dette resulterer i et lavere kogepunkt for alkohol.
Her er en hurtig sammenligning:
* Vand: Kogepunkt =100 ° C (212 ° F)
* ethanol (den mest almindelige alkohol): Kogepunkt =78,37 ° C (173 ° F)
Kort sagt er styrken af brintbindingerne mellem molekyler den primære faktor, der bestemmer kogepunktet.
Sidste artikelSukker opløses i vand, fordi begge består af?
Næste artikelHvad er ladningen af lithium og ilt?
 Varme artikler
Varme artikler
-
 Forskere afslører dynamikken mellem klynger og klynger mellem thiolatbeskyttede guld-sølvlegeringe…Kredit:CC0 Public Domain Fra effektiv medicin til molekylære sensorer til brændselsceller, metalklynger bliver grundlæggende nyttige i sundheden, miljø, og energisektorer. Denne forskelligartede f
Forskere afslører dynamikken mellem klynger og klynger mellem thiolatbeskyttede guld-sølvlegeringe…Kredit:CC0 Public Domain Fra effektiv medicin til molekylære sensorer til brændselsceller, metalklynger bliver grundlæggende nyttige i sundheden, miljø, og energisektorer. Denne forskelligartede f -
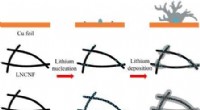 En letvægts nanofiberbaseret opsamlerSkematisk diagram af lithiumkernedannelse og aflejringsadfærd på Cu-folie, lavt nitrogen-dopingniveau carbon nanofiber-ramme og højt nitrogen-doping-niveau carbon-nanofiber-framework. Kredit:©Science
En letvægts nanofiberbaseret opsamlerSkematisk diagram af lithiumkernedannelse og aflejringsadfærd på Cu-folie, lavt nitrogen-dopingniveau carbon nanofiber-ramme og højt nitrogen-doping-niveau carbon-nanofiber-framework. Kredit:©Science -
 Et værktøj baseret på brugen af kulstofnanopartikler muliggør påvisning af antidepressiva i u…Mikroskop analyserer en prøve med brug af nanopartikler. Kredit:University of Cordoba En forskergruppe fra University of Cordoba har designet et værktøj, der muliggør påvisning af antidepressiva i
Et værktøj baseret på brugen af kulstofnanopartikler muliggør påvisning af antidepressiva i u…Mikroskop analyserer en prøve med brug af nanopartikler. Kredit:University of Cordoba En forskergruppe fra University of Cordoba har designet et værktøj, der muliggør påvisning af antidepressiva i -
 Skin et lys:Ny forskning viser, hvordan lavenergilys kan bøje plastikForskere afslørede en måde at bruge lavenergilys til at manipulere fotopolymerer eller plastfilm. Kredit:Florida State University Et hold af Florida State University-forskere har afsløret en måde a
Skin et lys:Ny forskning viser, hvordan lavenergilys kan bøje plastikForskere afslørede en måde at bruge lavenergilys til at manipulere fotopolymerer eller plastfilm. Kredit:Florida State University Et hold af Florida State University-forskere har afsløret en måde a
- Hvad er polyprotisk syre?
- Hvorfor det kan virke kontraproduktivt at bruge teknologi til at overvåge medarbejdere på arbejdet…
- Indfødte fiskearter i fare efter fjernelse af vand fra Colorado -floden
- Rødt guld:Afghanistans safranproduktion vokser
- Hvad sker der, når forstyrrelser i modsat retning mødes langs mediet?
- Sjælden russisk lyserød diamant sælges for 27 millioner dollars


