Det er vanskeligt at måle mængden af en gas, fordi?
* Gasser er komprimerbare: I modsætning til faste stoffer og væsker har gasser ikke noget fast volumen og kan komprimeres til mindre rum. Dette betyder, at volumen af en gas kan ændres afhængigt af det tryk, den udsættes for.
* Gasser udvides for at fylde deres containere: Gasser påtager sig formen og volumenet på deres beholder, hvilket gør det vanskeligt at måle deres iboende volumen.
* gasmolekyler bevæger sig konstant: Gasmolekyler bevæger sig tilfældigt og kolliderer med hinanden og beholdervæggene, hvilket gør det svært at definere en klar grænse eller form.
* Intermolekylære kræfter er svage: De svage attraktive kræfter mellem gasmolekyler betyder, at de ikke er tæt pakket sammen, hvilket gør det vanskeligt at måle mængden af en bestemt mængde gas.
Der er dog metoder til at måle mængden af gasser:
* ved hjælp af en gradueret cylinder: En gas kan opsamles over vand i en gradueret cylinder for at bestemme dens volumen.
* ved hjælp af en ideel gaslovligning: Den ideelle gaslov (PV =NRT) kan bruges til at beregne volumen af en gas, hvis tryk, temperatur og antallet af mol af gassen er kendt.
* ved hjælp af en gassprøjte: En gassprøjte kan bruges til at måle volumen af en gas ved at observere ændringen i volumen af sprøjtens stempel.
Mens måling af en gasvolumen kan være udfordrende, er det muligt med omhyggelige teknikker og passende værktøjer.
Sidste artikelVed konstant tryk varierer volumenet på 1 mol en ideel gas?
Næste artikelAlle undtagen to metaller har en hvilken farve?
 Varme artikler
Varme artikler
-
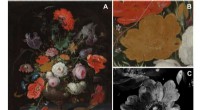 Kemisk og optisk billeddannelse forklarer, hvorfor en rose mistede sin farve i et berømt maleriPigmentnedbrydning i den gule rose i Abraham Mignons Stilleben med blomster og et ur. (A) Visuelt fotografi af stilleben med blomster og et ur af Abraham Mignon (1640-1679), olie på lærred, dateret ca
Kemisk og optisk billeddannelse forklarer, hvorfor en rose mistede sin farve i et berømt maleriPigmentnedbrydning i den gule rose i Abraham Mignons Stilleben med blomster og et ur. (A) Visuelt fotografi af stilleben med blomster og et ur af Abraham Mignon (1640-1679), olie på lærred, dateret ca -
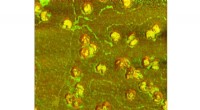 Ny metode giver forskere mulighed for hurtigt at se individuelle viruspartiklerEt sammensat billede af herpes simplex virus partikler, opnået af AFM-IR. (Billede udlånt af Dmitry Kurouski) Influenza, SARS-CoV-2 og andre vira kommer i en lang række forskellige former og størr
Ny metode giver forskere mulighed for hurtigt at se individuelle viruspartiklerEt sammensat billede af herpes simplex virus partikler, opnået af AFM-IR. (Billede udlånt af Dmitry Kurouski) Influenza, SARS-CoV-2 og andre vira kommer i en lang række forskellige former og størr -
 De dødelige, livgivende og forbigående grundstoffer, der udgør gruppe 15 i det periodiske systemHer er det periodiske system med alle grundstofferne blokeret undtagen dem i gruppe 15. Kredit:Julie Pollock, CC BY-SA Når du ser det periodiske system, hvad kommer til at tænke på? Brikkerne på e
De dødelige, livgivende og forbigående grundstoffer, der udgør gruppe 15 i det periodiske systemHer er det periodiske system med alle grundstofferne blokeret undtagen dem i gruppe 15. Kredit:Julie Pollock, CC BY-SA Når du ser det periodiske system, hvad kommer til at tænke på? Brikkerne på e -
 Skift af spor:Vende elektronernes kurs gennem naturens solcellerKredit:CC0 Public Domain Tænk på et tog, der kommer ned ad skinnerne til et skiftepunkt, hvor det kunne køre enten til højre eller venstre - og det kører altid til højre. Fotosyntetiske organisme
Skift af spor:Vende elektronernes kurs gennem naturens solcellerKredit:CC0 Public Domain Tænk på et tog, der kommer ned ad skinnerne til et skiftepunkt, hvor det kunne køre enten til højre eller venstre - og det kører altid til højre. Fotosyntetiske organisme
- Kan pizzaurter forhindre vinteropkastningssygdom?
- - Hvor mange gram vand skal der tilsættes for at fremstille en 2% opløsning efter masse med 16,5 g…
- Forskere identificerer fem faktorer for bedre kystrisikostyringsstrategier
- Smog kvæler kulafhængigt Polen uden ende
- Mars:Var Olympus Mons engang en kæmpe vulkanø?
- NASAs mineralstøvdetektor begynder at indsamle data


