Ved konstant tryk varierer volumenet på 1 mol en ideel gas?
v₁/t₁ =v₂/t₂
Hvor:
* V₁ er det oprindelige bind
* t₁ er den oprindelige temperatur (i Kelvin)
* V₂ er det endelige bind
* t₂ er den endelige temperatur (i Kelvin)
Forklaring:
* Når temperaturen på en ideel gas øges, øges den gennemsnitlige kinetiske energi for gasmolekylerne.
* Denne øgede kinetiske energi får molekylerne til at bevæge sig hurtigere og kollidere med containerens vægge oftere og med større kraft.
* For at opretholde konstant tryk skal containerens volumen stige for at imødekomme den større kraft af kollisionerne.
Ved konstant tryk, hvis du øger temperaturen på 1 mol af en ideel gas, vil dens volumen øges forholdsmæssigt.
Sidste artikelHvad vil der ske med gastrykket, når volumenet reduceres?
Næste artikelDet er vanskeligt at måle mængden af en gas, fordi?
 Varme artikler
Varme artikler
-
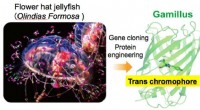 Syretolerant grønt fluorescerende protein til bioimagingEt skema over udviklingen af Gamillus. Gen af det fluorescerende protein blev klonet fra tentakler af blomsterhattevandmænd, og blev konstrueret til at forbedre den monomere egenskab og lysstyrken
Syretolerant grønt fluorescerende protein til bioimagingEt skema over udviklingen af Gamillus. Gen af det fluorescerende protein blev klonet fra tentakler af blomsterhattevandmænd, og blev konstrueret til at forbedre den monomere egenskab og lysstyrken -
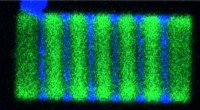 Ny klasse af bløde halvledere kunne transformere HD-skærmeEn 2-D plade, der viser skiftevis cæsium blychlorid (blå) og cæsium blybromid (grøn) segmenter. Kredit:Letian Dou/Berkeley Lab og Connor G. Bischak/UC Berkeley En ny type halvleder kan være på vej
Ny klasse af bløde halvledere kunne transformere HD-skærmeEn 2-D plade, der viser skiftevis cæsium blychlorid (blå) og cæsium blybromid (grøn) segmenter. Kredit:Letian Dou/Berkeley Lab og Connor G. Bischak/UC Berkeley En ny type halvleder kan være på vej -
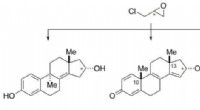 Forskere udvikler gennembrudsprocesser til at skabe kræft-dræbende lægemidlerEn ny kemisk vej fra simple kommercielt tilgængelige materialer til medicinsk-relevante molekyler. Kredit:Glenn Micalizio Et forskerhold ved Dartmouth College har udviklet en ny strategi for lægem
Forskere udvikler gennembrudsprocesser til at skabe kræft-dræbende lægemidlerEn ny kemisk vej fra simple kommercielt tilgængelige materialer til medicinsk-relevante molekyler. Kredit:Glenn Micalizio Et forskerhold ved Dartmouth College har udviklet en ny strategi for lægem -
 Forskere identificerer bristepunktet for at udføre materialeKredit:CC0 Public Domain En forbedret metode til at forudsige temperaturen, når plastik skifter fra smidig til skør, som potentielt kan fremskynde fremtidig udvikling af fleksibel elektronik, blev
Forskere identificerer bristepunktet for at udføre materialeKredit:CC0 Public Domain En forbedret metode til at forudsige temperaturen, når plastik skifter fra smidig til skør, som potentielt kan fremskynde fremtidig udvikling af fleksibel elektronik, blev
- Anvendelsen af tre-akse lavenergispektroskopi i kvantefysisk forskning
- Microseeding:En ny måde at overvinde hemihedral twinning?
- Hvor mange atomer er der i en prøve på 1,83 mol kalium (K) atomer?
- Undersøgelse finder, at religiøs programreklame hovedsageligt appellerer til frygt
- Vingårdsturisme er en stor kilde til kulstofemissioner; at købe mere vin på stedet kan hjælpe me…
- Grøntsagssammensætning kan have en central rolle i behandling af Alzheimers sygdom


