Diskuter de forskellige faktorer, der kan påvirke opløseligheden af et stof?
Faktorer, der påvirker opløselighed:En omfattende oversigt
Opløselighed, et stof (opløst) evne til at opløses i et andet stof (opløsningsmiddel), er et afgørende koncept i kemi. Det er påvirket af en kombination af faktorer, der hver spiller en betydelig rolle i bestemmelsen af, hvor meget opløst stof kan opløses i et givet opløsningsmiddel. Her er en detaljeret udforskning af disse faktorer:
1. Natur af opløst stof og opløsningsmiddel:
* "som opløser som": Dette grundlæggende princip angiver, at polære opløste stoffer opløses bedst i polære opløsningsmidler, mens ikke-polære opløste stoffer opløses bedst i ikke-polære opløsningsmidler.
* Eksempler: Sukker (polær) opløses let i vand (polær), mens olie (ikke-polær) opløses i benzin (ikke-polær).
* Intermolekylære kræfter: Styrken af interaktioner mellem opløst stof og opløsningsmiddelmolekyler dikterer opløselighed. Stærkere interaktioner, som hydrogenbinding i vand, fører til større opløselighed.
* Eksempler: Ethanol er med sin evne til at danne hydrogenbindinger meget opløselig i vand.
2. Temperatur:
* faste stoffer og væsker: For de fleste faste stoffer og væsker øger stigende temperatur opløselighed. Dette skyldes, at højere temperaturer giver mere energi til at bryde bindingerne mellem opløste partikler og give dem mulighed for at interagere mere effektivt med opløsningsmidlet.
* Eksempler: Sukker opløses hurtigere i varmt vand end i koldt vand.
* Gasser: For gasser reducerer stigende temperatur generelt opløselighed. Dette skyldes, at højere temperaturer øger den kinetiske energi af gasmolekyler, hvilket får dem til at flygte fra opløsningen.
* Eksempler: Du kan se denne effekt, når du opvarmer en sodavlaske - den opløste kuldioxid slipper ud som bobler.
3. Tryk:
* Gasser: Tryk har en betydelig effekt på opløseligheden af gasser. Henrys lov siger, at opløseligheden af en gas i en væske er direkte proportional med det delvise tryk på gassen over væsken. Højere tryk tvinger flere gasmolekyler ind i opløsningen.
* Eksempler: Kulsyreholdige drikkevarer under tryk for at opløse mere kuldioxid i væsken.
4. Partikelstørrelse:
* mindre partikler opløses hurtigere: Mindre partikler har et større forhold mellem overfladeareal og volumen, hvilket giver dem mulighed for at interagere med opløsningsmidlet lettere. Denne effekt handler primært om opløsningshastigheden, ikke den samlede opløselighed.
* Eksempler: Granuleret sukker opløses hurtigere end en sukkerterning.
5. Omrøring eller agitation:
* hurtigere opløsning: Omrøring eller agitation hjælper med at bringe frisk opløsningsmiddel i kontakt med opløstelsen, hvilket øger opløsningshastigheden. Det ændrer ikke den samlede opløselighed, men den fremskynder processen.
6. Tilstedeværelse af andre opløste stoffer:
* fælles ioneffekt: Hvis en opløsning allerede indeholder ioner, der ligner dem i opløstelsen, vil opløseligheden af opløsningen falde. Dette er kendt som den almindelige ioneffekt.
* Eksempler: Tilsætning af natriumchlorid til en mættet opløsning af sølvchlorid vil få noget sølvchlorid til at udfælde ud af opløsningen.
7. Ph:
* For nogle stoffer kan pH dramatisk påvirke opløselighed: For eksempel øges opløseligheden af nogle metalhydroxider i basale opløsninger, mens opløseligheden af nogle syrer øges i sure opløsninger.
8. Polaritet:
* polære opløste stoffer er mere opløselige i polære opløsningsmidler: Dette skyldes tiltrækningen mellem modsatte afgifter. For eksempel er vand (polær) et godt opløsningsmiddel for salte (ionisk og polær).
Konklusion:
Opløselighed er et komplekst fænomen påvirket af flere faktorer. At forstå disse faktorer er afgørende for at forudsige og manipulere opløseligheden af stoffer i forskellige anvendelser, der spænder fra kemiske reaktioner til lægemiddelforsyning og miljømæssig sanering.
Sidste artikelHvilken væske vil rustne en søm?
Næste artikelHvad vil der ske med gastrykket, når volumenet reduceres?
 Varme artikler
Varme artikler
-
 Kemikere udvikler en ny metode til syntese af polymer-nanopartikler af en given størrelseRUDN Chemist har udviklet en ny metode til syntese af polymer-nanopartikler af en given størrelse. Kredit:Allen Dressen En kemiker fra RUDN skabte teknologien til syntese af polymer nanosfærer til
Kemikere udvikler en ny metode til syntese af polymer-nanopartikler af en given størrelseRUDN Chemist har udviklet en ny metode til syntese af polymer-nanopartikler af en given størrelse. Kredit:Allen Dressen En kemiker fra RUDN skabte teknologien til syntese af polymer nanosfærer til -
 Hvordan formen påvirker en chokoladebars krystallinske strukturChokoladeforme påvirker chokoladens krystallinske struktur. Kredit:Popovphoto/Shutterstock.com Når du nyder en chokoladebar, de fleste mennesker tænker ikke over, hvordan molekylerne i det er orga
Hvordan formen påvirker en chokoladebars krystallinske strukturChokoladeforme påvirker chokoladens krystallinske struktur. Kredit:Popovphoto/Shutterstock.com Når du nyder en chokoladebar, de fleste mennesker tænker ikke over, hvordan molekylerne i det er orga -
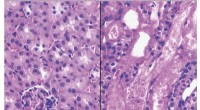 Anti-aldringsmolekylet NAD+ får et løft ved at blokere et enzymHistologisk snit af en normal nyre (venstre) versus en nyre efter akut nyreskade (højre). Kredit:J. Auwerx, EPFL Nikotinamid adenin dinukleotid (NAD+) er en vigtig spiller inden for ernæring i dag
Anti-aldringsmolekylet NAD+ får et løft ved at blokere et enzymHistologisk snit af en normal nyre (venstre) versus en nyre efter akut nyreskade (højre). Kredit:J. Auwerx, EPFL Nikotinamid adenin dinukleotid (NAD+) er en vigtig spiller inden for ernæring i dag -
 Aske fra kraftværker forarbejdet til reagenser til vandrensningKredit:CC0 Public Domain Russiske metallurger har foreslået at opløse askeaffaldet fra termiske kraftværker med saltsyre ved højt tryk. De resulterende forbindelser kan anvendes til vandbehandling
Aske fra kraftværker forarbejdet til reagenser til vandrensningKredit:CC0 Public Domain Russiske metallurger har foreslået at opløse askeaffaldet fra termiske kraftværker med saltsyre ved højt tryk. De resulterende forbindelser kan anvendes til vandbehandling
- Hvad er plantetilpasningerne i flodmundinger?
- Oak Ridge,
- Mælkevejen forbinder med naboen i galaktisk våbenkapløb
- 2-sidet 2-D-materiale er det første hos Rice
- Humor er både en forhindring og en målestok for at forbedre AI, menneskelig interaktion
- Hvordan ændres fotosynteseprocessen i løbet af en hel dag?


