Hvilke former kan opløses i væsker?
almindelige former, der opløses i væsker:
* faste stoffer:
* salte: Bordsalt (NaCl), sukker (saccharose), kaliumchlorid (KCL)
* syrer: Citronsyre, eddikesyre (eddike), saltsyre (HCI)
* baser: Natriumhydroxid (NaOH), kaliumhydroxid (KOH)
* Metaller: Nogle metaller, som natrium og kalium, reagerer kraftigt med vand for at opløses.
* Andre faste stoffer: Mange faste stoffer som gelatine, stivelse og nogle polymerer kan opløses eller danne suspensioner i væsker.
* væsker:
* Alkoholer: Ethanol, methanol
* syrer: Salpetersyre, svovlsyre
* baser: Ammoniakopløsning
* Andre væsker: Lykbare væsker, som vand og ethanol, kan opløses fuldstændigt i hinanden.
* Gasser:
* kuldioxid: Opløses i vand for at skabe kulsyre.
* ilt: Opløser i vand, dog ikke meget.
* nitrogen: Opløses i vand, men endnu mindre end ilt.
Faktorer, der påvirker opløsningen:
* opløselighed: Et opløst stof til at opløses i et opløsningsmiddel kaldes opløselighed. Det er påvirket af faktorer som:
* Polaritet: "Som opløser som". Polære opløste stoffer (som sukker) har en tendens til at opløses i polære opløsningsmidler (som vand), mens ikke-polære opløste stoffer (som olie) opløses i ikke-polære opløsningsmidler (som benzin).
* Temperatur: Opløselighed øges ofte med temperaturen.
* tryk: For gasser øges opløseligheden med tryk.
* Intermolekylære kræfter: Stærkere interaktioner mellem opløst stof og opløsningsmiddelmolekyler fører til højere opløselighed.
Vigtig note:
* Ikke alle stoffer opløses i alle væsker. For eksempel opløses olie ikke i vand, fordi de har forskellige polariteter.
* Processen med opløsning involverer dannelse af nye bindinger mellem opløst stof og opløsningsmiddelmolekyler.
Fortæl mig, hvis du gerne vil have mere specifik information om at opløse visse stoffer.
Sidste artikelHvad er et stof, som opløsning af opløsningsmiddelopløsning og sediment?
Næste artikelNavn givet til de væsker, der opløses?
 Varme artikler
Varme artikler
-
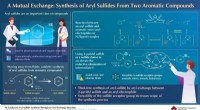 Syntetisering af arylsulfider fra ikke-lugtende, ikke-giftige forbindelserNi-katalyseret arylsulfidsyntese gennem en arylbytningsreaktion. Kredit:Waseda University Arylsulfid, en aromatisk forbindelse, hvor svovl er bundet til en aryl (en funktionel gruppe afledt af en
Syntetisering af arylsulfider fra ikke-lugtende, ikke-giftige forbindelserNi-katalyseret arylsulfidsyntese gennem en arylbytningsreaktion. Kredit:Waseda University Arylsulfid, en aromatisk forbindelse, hvor svovl er bundet til en aryl (en funktionel gruppe afledt af en -
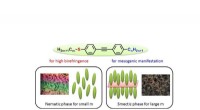 Svovl forbedrer dobbeltbrydningen til udvikling af flydende krystallinske molekylerBilleder af alkylthiogruppestavlignende molekyler, der udviser flydende krystallinitet ved stuetemperatur, og fasestrukturerne. Kredit:Toyohashi University of Technology Et team af forskere ledet
Svovl forbedrer dobbeltbrydningen til udvikling af flydende krystallinske molekylerBilleder af alkylthiogruppestavlignende molekyler, der udviser flydende krystallinitet ved stuetemperatur, og fasestrukturerne. Kredit:Toyohashi University of Technology Et team af forskere ledet -
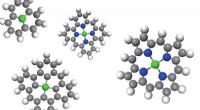 Simpel ligning styrer skabelsen af ren-energi katalysatorerTilpasset fra figur i Nature Catalysis / Springer Nature. Kredit:University of Nebraska-Lincoln Nye retningslinjer fastsat af Nebraska og kinesiske forskere kunne styre designet af billigere, mere
Simpel ligning styrer skabelsen af ren-energi katalysatorerTilpasset fra figur i Nature Catalysis / Springer Nature. Kredit:University of Nebraska-Lincoln Nye retningslinjer fastsat af Nebraska og kinesiske forskere kunne styre designet af billigere, mere -
 Ioner i smeltede salte kan gå imod strømmenKredit:CC0 Public Domain I en ny artikel offentliggjort i det videnskabelige tidsskrift Kommunikationskemi , en forskergruppe ved Uppsala Universitet viser, ved hjælp af computersimuleringer, at
Ioner i smeltede salte kan gå imod strømmenKredit:CC0 Public Domain I en ny artikel offentliggjort i det videnskabelige tidsskrift Kommunikationskemi , en forskergruppe ved Uppsala Universitet viser, ved hjælp af computersimuleringer, at
- NASA finder kraftig regn, vindskydning og tårnhøje skyer i den tropiske storm Saola
- Didi, SoftBank oprettede taxa-haiing joint venture i Japan
- Ny undersøgelse:Fracking forårsager global stigning i atmosfærisk metan
- Madeannoncer på Twitch kan føre til trang, køb
- Er glade mennesker pænere?
- Mikrostruktureret materiale med rumlig variation har kun friktion i én retning


