Syntetisering af arylsulfider fra ikke-lugtende, ikke-giftige forbindelser
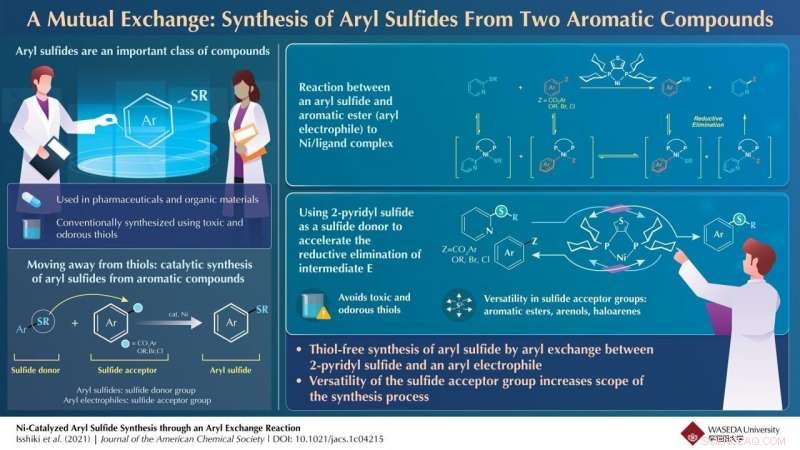
Ni-katalyseret arylsulfidsyntese gennem en arylbytningsreaktion. Kredit:Waseda University
Arylsulfid, en aromatisk forbindelse, hvor svovl er bundet til en aryl (en funktionel gruppe afledt af en aromatisk ring), findes i biologisk aktive materialer, der er effektive mod astma, Alzheimers sygdom, og kræft. Som resultat, kemikere har vist stor interesse for at syntetisere arylsulfider. Traditionelt, carbon-svovl (C-S) bindingsdannelsesreaktioner mellem thioler og arylelektrofiler katalyseret af overgangsmetaller er blevet anvendt til arylsulfidsyntese på grund af deres høje pålidelighed. Imidlertid, thioler har en ubehagelig lugt og er giftige. Kunne der være en måde at syntetisere arylsulfider på, der undgår brugen af thioler?
Et team af kemikere fra Waseda University, Japan, ledet af professor Junichiro Yamaguchi adresserer dette spørgsmål i en nylig undersøgelse offentliggjort i Journal of the American Chemical Society , og har fundet frem til en teknik, der får arbejdet gjort uden thioler. Holdet tog tippet fra en tidligere undersøgelse, hvor de brugte en nikkelkatalysator til at syntetisere aromatiske estere fra to aromatiske forbindelser. "I 2020 vi udviklede den første estersyntesemetode ved hjælp af aromatiske ringudvekslingsreaktioner og besluttede at anvende den viden, der blev opnået fra denne reaktion, til at realisere en thiolfri sulfidsyntese, " forklarer Yamaguchi, taler om undersøgelsens oprindelse.
På denne baggrund, holdet satte sig for at syntetisere arylsulfider og aromatiske estere. De startede med at reagere 4-tolylsulfid og 4-phenylbenzoat i nærvær af en nikkelkatalysator og fandt ud af, at det ønskede arylsulfid blev syntetiseret i nærvær af en ligand, dcypt, og et zinkadditiv, Zn(OAc) 2 .
Opmuntret af resultaterne, holdet gik videre for at undersøge reaktionens mekanisme. De reagerede arylsulfidet med nikkelkatalysatoren (Ni(torsk) 2 ) og liganden, dcypt, og observerede dannelsen af et nikkelkompleks bestående af katalysatoren, liganden, og arylsulfidet. Dette nikkelkompleks kunne reagere med den aromatiske ester til dannelse af et par nikkelkomplekser, som kunne reagere med hinanden for at danne det ønskede arylsulfid.
Et team af kemikere fra Waseda University, Japan, satte sig for at syntetisere arylsulfider under anvendelse af arylsulfider og aromatiske estere efter udvikling af en estersyntese, der involverer en aromatisk ringbytning. Kredit:Junichiro Yamaguchi fra Waseda University, Japan
Ud fra disse reaktioner, holdet konkluderede, at den Ni-katalyserede arylsulfidsyntese fandt sted i en række trin. I første omgang, arylsulfid og aromatiske estere undergik samtidige oxidative additionsreaktioner til nikkel/ligand-katalysatoren under dannelse af nikkelkomplekser. Disse nikkelkomplekser kunne indgå i en aryludvekslingsreaktion for at danne et sæt nikkelmellemprodukter. Dette blev derefter efterfulgt af den reduktive eliminering af mellemprodukterne for at regenerere Ni/ligand-katalysatoren og danne det ønskede arylsulfid.
Den reduktive eliminering af nikkelmellemprodukter, imidlertid, reducerede udbyttet af arylsulfidet. For at bekæmpe dette, holdet brugte 2-pyridylsulfid, som fremskyndede dette begrænsende trin, forbedring af udbyttet. Derudover syntesemetoden arbejdede med flere arylelektrofiler såsom aromatiske estere, arenolderivater og arylhalogenider.
"Den udviklede sulfidsyntesemetode kan fortsætte for en række komplekse bioaktive forbindelser såsom probenecid, flavon, estron, phenylalanin, umbelliferon, og β-isocupreidinderivater, " kommenterer en begejstret Yamaguchi, overvejer udsigterne for deres nye synteseteknik. "Desuden, Evnen til at bruge miljøvenlige aromatiske estere og phenolderivater som råmateriale og pyridylsulfid som et sulfidmiddel kunne gøre denne teknologi velegnet til både laboratorie- og industriel skalaapplikationer."
Sidste artikelUdfordringen med at fange kulstof
Næste artikelRadikal kemi muliggør ligetil syntese af ethere
 Varme artikler
Varme artikler
-
 For fotokatalysatorer, at klare tidens tand betyder at finde en perfekt partnerKredit:Pixabay/CC0 Public Domain Nøglen til effektivt at høste energi fra sollys kunne være at finde de rigtige kombinationer af lysfangende materialer. Forskere ved KAUST har opdaget, at en form
For fotokatalysatorer, at klare tidens tand betyder at finde en perfekt partnerKredit:Pixabay/CC0 Public Domain Nøglen til effektivt at høste energi fra sollys kunne være at finde de rigtige kombinationer af lysfangende materialer. Forskere ved KAUST har opdaget, at en form -
 Forskere foreslår en ny strategi for elektrokemisk reduktion af kuldioxidDifferentialladningsdiagrammet for SnS/Aminated-C for (a) og den delvise strømtæthed af formiatproduktion for SnS og SnS/Aminated-C for (b). Kredit:CHEN Zhipeng Kuldioxid (CO 2 ) emission er ble
Forskere foreslår en ny strategi for elektrokemisk reduktion af kuldioxidDifferentialladningsdiagrammet for SnS/Aminated-C for (a) og den delvise strømtæthed af formiatproduktion for SnS og SnS/Aminated-C for (b). Kredit:CHEN Zhipeng Kuldioxid (CO 2 ) emission er ble -
 Forskere trykker regnbuefarvestoffer på skinnende chokoladeKredit:ETH Zürich ETH-forskere får chokolade til at skinne i regnbuefarver uden tilsætning af farvestoffer. De har fundet en måde at præge en speciel struktur på overfladen af chokoladen for at
Forskere trykker regnbuefarvestoffer på skinnende chokoladeKredit:ETH Zürich ETH-forskere får chokolade til at skinne i regnbuefarver uden tilsætning af farvestoffer. De har fundet en måde at præge en speciel struktur på overfladen af chokoladen for at -
 Silkeorme giver nyt spin på klæbrige molekylerTeamet har konstrueret silkeorme til at producere E-selectin, et kritisk adhæsionsmolekyle involveret i betændelse, kræft og andre sygdomsprocesser. Kredit:Takahiro Kusakabe &Jae Man Lee, Kyushu Unive
Silkeorme giver nyt spin på klæbrige molekylerTeamet har konstrueret silkeorme til at producere E-selectin, et kritisk adhæsionsmolekyle involveret i betændelse, kræft og andre sygdomsprocesser. Kredit:Takahiro Kusakabe &Jae Man Lee, Kyushu Unive


